题目内容
下列说法正确的是(NA表示阿伏加德罗常数)( )
| A、1mol钠和足量水反应可生成11.2L氢气 |
| B、常温常压下,32g氧气中含有2NA个氧分子 |
| C、1mol/LK2SO4溶液中,含有2mol钾离子 |
| D、标准状况下,22.4LHCl溶于水后溶液中含有NA个氢离子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.不知道气体的状态,Vm不确定;
B.质量转化为物质的量;
C.溶液的体积未知,无法计算;
D.体积转化物质的量,结合氯化氢为强电解质,完全电离解答.
B.质量转化为物质的量;
C.溶液的体积未知,无法计算;
D.体积转化物质的量,结合氯化氢为强电解质,完全电离解答.
解答:
解:A.气体的状态不知道,Vm值不一定等于22.4L/mol,故A错误;
B.32g氧气的物质的量=
=1mol,含有氧原子个数NA个,故B错误;
C.溶液体积未知,无法计算,故C错误;
D.标准状况下,22.4LHCl的物质的量=
=1mol,氯化氢为强电解质,所以溶液中含有氢离子NA个,故D正确;
故选:D.
B.32g氧气的物质的量=
| 32g |
| 32g/mol |
C.溶液体积未知,无法计算,故C错误;
D.标准状况下,22.4LHCl的物质的量=
| 22.4L |
| 22.4L/mol |
故选:D.
点评:本题考查了阿伏伽德罗常数的判断及计算,熟练掌握物质的量与阿伏伽德罗常数等物理量之间的转化关系是解题关键,注意气体摩尔体积的使用条件.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
硝酸铜是制备Cu-Zn-Al系催化剂的重要原料.现有三种制取硝酸铜的实验方案可供选用下列说法正确的是( )
①铜与稀硝酸反应制取:3Cu+8HNO3(稀)
3Cu(NO3)2+2NO↑+4H2O
②铜与浓硝酸反应制取:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
③首先将铜屑在空气中加热生成氧化铜,氧化铜与稀硝酸反应制取:
2Cu+O2
2CuO,CuO+2HNO3=Cu(NO3)2+H2O.
①铜与稀硝酸反应制取:3Cu+8HNO3(稀)
| ||
②铜与浓硝酸反应制取:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
③首先将铜屑在空气中加热生成氧化铜,氧化铜与稀硝酸反应制取:
2Cu+O2
| ||
| A、制取等量的硝酸铜,需硝酸的量②最少 |
| B、制取等量的硝酸铜,②产生的有毒气体比①少 |
| C、三种方案中,硝酸的利用率为③>①>② |
| D、三种方案的反应都可以在铁质容器中进行 |
化学与工农业生产、人类生活都有密切相关,下列说法中正确的是( )
| A、高纯度的二氧化硅晶体广泛用作制造光导纤维和太阳能电池板材料 |
| B、葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
| C、铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 |
| D、海水中含有钾、钠元素,只需经过物理变化就可以得到钾和钠单质 |
CH4与O2的混合气体对氢气的相对密度为10,下列对该混合气体组成的描述正确的是( )
| A、V(CH4):V(O2)=3:1 |
| B、m(CH4):m(O2)=3:2 |
| C、n(CH4):n(O2)=3:2 |
| D、M(CH4):M(O2)=3:1 |
在碱性溶液中,能大量共存的离子组是( )
| A、K+、HCO3-、Na+、SO42- |
| B、Na+、Cu2+、SO42-、Cl- |
| C、Ba2+、NO3-、Cl-、K+ |
| D、Ca2+、K+、CO32-、NO3- |
下列反应的离子方程式,书写错误的是( )
| A、氧化钠与水反应:Na2O+H2O═2Na++2OH- |
| B、稀硫酸与氧化铁反应:Fe2O3+6H+═2Fe3++3H2O |
| C、食盐水中滴加硝酸银溶液:Cl-+Ag+═AgCl↓ |
| D、氢氧化钡溶液跟硫酸铜溶液反应:Ba2++SO42-═BaSO4↓ |
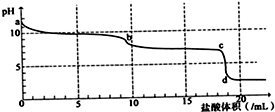 常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如图,则下列说法正确的是( )
常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如图,则下列说法正确的是( )| A、a点时溶液pH=11.5,原因是:CO32-+H2O→HCO3-+OH- |
| B、a-b段发生反应为:CO32-+2H+→CO2↑+H2O |
| C、b-c段发生反应为:HCO3-+H+→CO2↑+H2O |
| D、c-d段发生反应为:H++OH-→H2O |

 ,R、R′均为烃基
,R、R′均为烃基