题目内容
下列各组离子在指定条件下能大量共存的是
①漂白粉的水溶液中:Fe2+、Cl-、Ca2+、Na+
②滴加石蕊试液呈红色的溶液:K+、NH4+、Cl-、S2-
③能够与金属Cu常温下反应放出气体的溶液:Fe3+、Al3+、SO42-、K+
④常温下pH =2的溶液中:NH4+、Na+、Cl-、Cu2+
⑤无色溶液中:K+、CH3COO-、HCO3-、MnO4-
A、②③ B、①③ C、③④ D、①⑤
C
【解析】
试题分析:如果离子间能发生化学反应,则不能大量共存,反之是可以的。①漂白粉的水溶液具有强氧化性,则溶液中Fe2+被氧化不能大量共存;②滴加石蕊试液呈红色的溶液显书写,则S2-转化为H2S不能大量共存;③能够与金属Cu常温下反应放出气体的溶液是硝酸,具有强氧化性,则溶液中Fe3+、Al3+、SO42-、K+之间不反应,可以大量共存;④常温下pH=2的溶液显酸性,则NH4+、Na+、Cl-、Cu2+之间不反应,可以大量共存;⑤无色溶液中MnO4-不能大量共存,答案选C。
考点:考查离子共存的正误判断

 字词句段篇系列答案
字词句段篇系列答案(10分)工业上利用电解污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
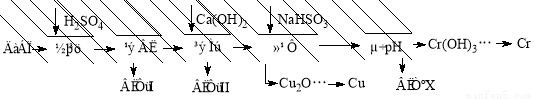
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀pH | 2.1 | 4.7 | 4.3 |
完全沉淀pH | 3.2 | 6.7 | a |

(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有 。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH范围为: ~ ;②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式 ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。



