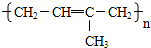题目内容
1.Na2S2O3可用作纺织工业氯气漂白布匹后的“脱氯剂”,4Cl2+Na2S2O3+5H2O═2NaCl+2H2SO4+□,有关该反应的叙述不正确的是( )| A. | Na2S2O3是还原剂 | |
| B. | 根据该反应可判断氧化性:Cl2>SO42-、 | |
| C. | □的物质是HCl | |
| D. | 上述反应中,每生成1mol SO42-,转移2mole- |
分析 由原子及电子守恒可知,反应为4Cl2+Na2S2O3+5H2O=2NaCl+2H2SO4+6HCl,S元素的化合价由+2价升高为+6价,Cl元素的化合价由0降低为-1价,以此来解答.
解答 解:由原子及电子守恒可知,反应为4Cl2+Na2S2O3+5H2O=2NaCl+2H2SO4+6HCl,
A.S元素的化合价升高,Na2S2O3是还原剂,故A正确;
B.Cl2为氧化剂,H2SO4是氧化产物,由氧化剂的氧化性大于氧化产物的氧化性可知氧化性:Cl2>SO42-,故B正确;
C.由原子守恒可知□的物质是HCl,故C正确;
D.上述反应中,每生成1mol SO42-,转移1mol×(6-2)=4mole-,故D错误;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
13.下列离子方程式中,正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ | |
| C. | 硝酸银溶液中加入铜粉:Ag++Cu═Cu2++Ag↓ | |
| D. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
14.NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 在标准状况下,分子总数为NA的H2和O2混合气体,其体积约为22.4L | |
| B. | 5.6g铁与足量的氯气反应,转移电子数为0.2NA | |
| C. | 11.2LH2O所含有的原子数为1.5NA | |
| D. | 0.2mol/L的Na2CO3溶液中含有的Na+数为0.4NA |
10.向1L 1mol/L AlCl3溶液中滴加一定量的NaOH溶液,若产生沉淀为0.8mol,则消耗的NaOH的物质的量可能是( )
| A. | 0.8 mol | B. | 2.8 mol | C. | 3.2 mol | D. | 3.8 mol |
17.下列各组物质属于非电解质的是( )
| A. | BaSO4 | B. | CH3COOH | C. | 酒精 | D. | O2 |
9.分子式为C8H10的芳香烃有( )种.
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
10.X、Y、Z、W是原子序数依次增大的4种短周期元素.X与Z位于同一主族,X原子的最外层电子数是次外层电子数的2倍,Y元素的单质既能与盐酸反应又能与NaOH溶液反应,X、Y、Z、W原子的最外层电子数之和为18.下列说法不正确的是( )
| A. | X单质在一定条件下能与Z的最高价氧化物发生置换反应 | |
| B. | 原子半径:Y>Z>W | |
| C. | 最高价氧化物对应水化物的酸性由弱到强的顺序:X<Z<W | |
| D. | 室温下,0.1mol/LW的气态氢化物的水溶液的pH=1 |
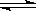 2SO3(g)从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是( )
2SO3(g)从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是( ) 石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已忽略).在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水.
石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已忽略).在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水.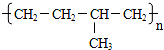 B.
B.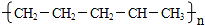
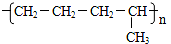 D.
D.