题目内容
5.在一定条件下,向一体积为2L的恒容密闭容器中充入2mol A、1mol B,发生反应:2A(g)+B(g)?3C(g)△H=-Q kJ/mol(Q>0).经过60s达到平衡,测得B的物质的量为0.4mol,下列对该平衡的叙述正确的是( )| A. | 用C表示该反应的速率为0.03mol/(L•s) | |
| B. | 达到平衡,测得放出热量为x kJ,则x=Q | |
| C. | 若向容器中再充入1 mol C,重新达到平衡,A的体积分数保持不变 | |
| D. | 若升高温度,则V(逆)增大,V(正)减小,平衡逆向移动 |
分析 经过60s达到平衡,测得B的物质的量为0.4mol,则
2A(g)+B(g)═3C(g)
起始量(mol) 2 1 0
变化量(mol) 1.2 0.6 1.8
平衡量(mol) 0.8 0.4 1.8
A.结合v=$\frac{△c}{△t}$计算;
B.反应是可逆反应,不能进行彻底;
C.若向容器再充入1mol C,压强增大,重新达到平衡,与原平衡是等效平衡;
D.升高温度正逆反应均增大.
解答 解:经过60s达到平衡,测得B的物质的量为0.4mol,则
2A(g)+B(g)═3C(g)
起始量(mol) 2 1 0
变化量(mol) 1.2 0.6 1.8
平衡量(mol) 0.8 0.4 1.8
A.用C表示该反应的速率为$\frac{\frac{1.8mol}{2L}}{60s}$=0.015mol/(L•s),故A错误;
B.反应是可逆反应,不能进行彻底,所以达到平衡,测得放出热量为x kJ,则x<Q,故B错误;
C.恒容恒温时,若向容器再充入1mol C,压强增大,重新达到平衡,与原平衡是等效平衡,所以A的体积分数保持不变,故C正确;
D.升高温度正逆反应均增大,即V(逆)、V(正)增大,该反应为放热反应,则升高温度平衡逆向移动,故D错误;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、速率计算、平衡移动为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大.

练习册系列答案
相关题目
16.已知:2H2(g)+O2(g)=2H2O(g),1molH2完全燃烧放出热量241.8KJ,有关键能数据如下:
则H-H键键能为( )
| 化学键 | H-O | O=O |
| 键能/KJ?mol-1 | 463.4 | 498 |
| A. | 413KJ/mol | B. | 557KJ/mol | C. | 221.6KJ/mol | D. | 436KJ/mol |
20.下列说法正确的是( )
| A. | 中和热一定是强酸跟强碱反应放出的热量 | |
| B. | 1 mol酸与1 mol碱完全反应放出的热量是中和热 | |
| C. | 在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热 | |
| D. | 表示中和热的离子方程式为:H+(aq)+OH-(aq)=H2O(l)△H=57.3KJ/mol |
14.向淀粉溶液中加入少量的稀硫酸,加热使之发生水解,为测定水解程度,需要加入下列试剂中的①NaOH溶液;②银氨溶液;③新制的Cu(OH)2悬浊液;④碘水;⑤BaCl2溶液,组合正确的是( )
| A. | ①⑤ | B. | ②④ | C. | ①②④ | D. | ②③④ |
15.食物是维持人类生命和健康的支柱.如表是某食品包装袋上的说明:
对表中各种配料的成分的理解正确的是( )
| 品名 | 蔬菜苏打饼 |
| 配料 | 面粉、鲜鸡蛋、精炼食用植物油、白砂糖、奶油、食盐、脱水青菜、橙汁 |
| 保质期 | 十二个月 |
| 生产日期 | 2016 年8月20日 |
| A. | 富含蛋白质的是鸡蛋 | |
| B. | 富含维生素的是脱水青菜和橙汁 | |
| C. | 富含糖类的物质只有白砂糖 | |
| D. | 富含油脂的是精炼食用植物油和奶油 |
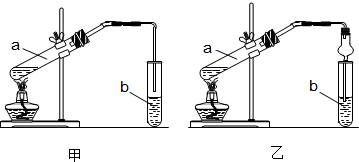
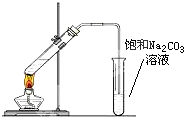 实验室可以用图所示的装置制取乙酸乙酯.回答下列问题:
实验室可以用图所示的装置制取乙酸乙酯.回答下列问题: