题目内容
从碘水溶液中提取碘,可选用的分离方法为( )
| A、萃取分液法 | B、过滤法 |
| C、结晶法 | D、蒸馏法 |
考点:物质的分离、提纯的基本方法选择与应用,物质的分离、提纯和除杂
专题:化学实验基本操作
分析:碘易溶于有机溶剂,不易溶于水,以此来解答.
解答:
解:A.碘易溶于有机溶剂,不易溶于水,可用苯、四氯化碳等有机溶剂萃取,然后分液分离,故A正确;
B.过滤适用于不溶性固体与液体的分离,不能从碘水中提取碘,故B错误;
C.结晶法使利用溶解度的差异分离混合物的方法,不能从碘水中提取碘,故C错误;
D.蒸馏法是利用沸点不同分离混合物的方法,不能从碘水中提取碘,故D错误;
故选A.
B.过滤适用于不溶性固体与液体的分离,不能从碘水中提取碘,故B错误;
C.结晶法使利用溶解度的差异分离混合物的方法,不能从碘水中提取碘,故C错误;
D.蒸馏法是利用沸点不同分离混合物的方法,不能从碘水中提取碘,故D错误;
故选A.
点评:本题考查物质的分离方法的选择,侧重于学生的实验能力的考查,为高考常见题型,注意把握物质的性质的异同,为解答该题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 如图是周期表中短周期的一部分,X、Y、Z三种元素原子核外电子数之和等于Y的质量数,Y原子核内质子数与中子数相等,下列叙述不正确的是( )
如图是周期表中短周期的一部分,X、Y、Z三种元素原子核外电子数之和等于Y的质量数,Y原子核内质子数与中子数相等,下列叙述不正确的是( )| A、X元素最高价氧化物对应的水化物具有强氧化性和不稳定性 |
| B、Y元素的常见氧化物、气态氢化物的水溶液均是酸 |
| C、Z元素的单质能与水剧烈反应 |
| D、X、Y、Z的最高价含氧酸及气态氢化物的水溶液都是强酸 |
0.1mol阿斯匹林(结构简式为 )与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
)与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
 )与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
)与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )| A、0.1mol |
| B、0.2 mol |
| C、0.4 mol |
| D、0.3 mol |
下列指定反应的离子方程式正确的是( )
| A、Cu溶于稀HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O |
| B、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ |
| C、用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
| D、向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
 氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强,25℃时氯气-氯水体系中存在以下平衡关系:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强,25℃时氯气-氯水体系中存在以下平衡关系:Cl2(g)?Cl2(aq) K1=10-1.2
Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4
HClO?H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示,下列表述正确的是( )
| A、Cl2(g)+H2O?2H++ClO-+Cl- K=10-10.9 |
| B、在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-) |
| C、用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差 |
| D、氯处理饮用水时,在夏季的杀菌效果比在冬季好 |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( )
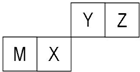

| A、M的离子半径小于Z的离子半径 |
| B、M和Y的最高价氧化物对应水化物之间能相互反应 |
| C、X的单质可以做光导纤维和半导体材料 |
| D、常温下,0.01mol/L的Y的气态氢化物的水溶液的pH=12 |
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是( )
| A、FeO |
| B、Fe2O3 |
| C、FeSO4 |
| D、Fe3O4 |
下列溶液中粒子的物质的量浓度关系正确的是( )
| A、0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B、20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| C、室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) |
| D、0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |