题目内容
9.由CO2、CO和H2组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、CO和H2的体积比为( )| A. | 29:13:8 | B. | 13:29:8 | C. | 22:14:1 | D. | 26:57:15 |
分析 由于CO与N2具有相同的相对分子质量,所以CO2、H2、CO混合气体的平均相对分子质量仅由CO2和H2来决定,CO的量可以任意,用十字交叉法可以得出结果.
解答 解:由于CO与N2具有相同的相对分子质量,所以CO2、H2、CO混合气体的平均相对分子质量仅由CO2和H2来决定,CO的量可以任意.由交叉法:
由十字交叉法可求得CO2和H2的体积比为26:16或13:8时(CO的量可以任意),混合气体的平均分子量为28,
故选B.
点评 本题考查混合物的计算,为高频考点,题目难度中等,侧重于学生的分析能力和计算能力的考查,根据相同条件下气体的密度之比等于相对分子质量之比计算即可,注意十字交叉法的运用.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
20.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取绿矾(FeSO4•7H2O),设计了如下流程,下列说法不正确的是( )
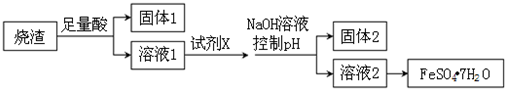

| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O | |
| D. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 |
4.下列说法正确的是( )
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H相同 | |
| D. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
14.在某密闭容器中发生可逆反应:2A(g)+B(?)?2C(g)△H;不同温度条件下C的质量分数(c%)符合图1所示的关系.下列说法正确的是( )


| A. | 正反应吸热,且B一定为气态 | |
| B. | 混合气体的平均摩尔质量随温度变化如图2所示 | |
| C. | 平衡后保持恒容,充入稀有气体,A的转化率增大 | |
| D. | 平衡后保持恒压,充入稀有气体,C的百分含量减小 |
1. 按如图所示装置进行下列不同的操作,其中不正确的是( )
按如图所示装置进行下列不同的操作,其中不正确的是( )
 按如图所示装置进行下列不同的操作,其中不正确的是( )
按如图所示装置进行下列不同的操作,其中不正确的是( )| A. | 铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2 | |
| B. | 只接通K1,一段时间后,U形管中出现白色沉淀 | |
| C. | 只接通K2,U形管左、右两端液面均下降 | |
| D. | 先只接通K1,一段时间后,漏斗液面上升,然后再只接通K2,漏斗液面下降 |
18.下列说法中正确的是( )
| A. | 0.1mol•L-1的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| B. | 标准状况下,2.24L水的质量是1.8g | |
| C. | 16gO3比16gO2所含的氧原子数多 | |
| D. | 22gCO2与标准状况下11.2L Cl2含有相同的分子数 |
 下图是盐酸与氢氧化钠溶液的滴定曲线a和b.
下图是盐酸与氢氧化钠溶液的滴定曲线a和b.