题目内容
8.某工厂排放的废液中含有少量硫酸和硫酸铜,小军同学取适量废液放入盛有一定量锌粉的烧杯中,搅拌,待充分反应后过滤,得少量滤渣和滤液,关于该实验,下列说法正确的是( )| A. | 发生的反应都是置换反应 | B. | 实验所得滤液是纯水,可直接排放 | ||
| C. | 滤渣中一定含铜和锌 | D. | 反应前后液体的酸性减弱,pH变小 |
分析 根据金属活动性顺序表可知,锌和稀硫酸及硫酸铜都能发生置换反应,生成物中有硫酸锌和铜以及氢气,如果反应物的量不同,反应后剩余的物质就不一样.
解答 解:A、锌和稀硫酸及硫酸铜都能发生置换反应,分别生成氢气和Cu,故A正确;
B、因为锌和稀硫酸及硫酸铜都能发生反应,生成物中有硫酸锌和铜以及氢气,所以滤液中的溶质主要是硫酸锌,不是纯水,故B错误;
C、滤渣中一定含铜,可能含有锌,如果锌的量比较少,没有使酸和硫酸铜完全反应,滤渣中就没有锌,此故C错误;
D、反应消耗氢离子,则溶液的酸性减弱,pH增大,故D错误.
故选A.
点评 本题考查了金属的性质、置换反应的概念、溶液酸碱性与pH的关系,题目难度不大,主要把握置换反应的概念.

练习册系列答案
相关题目
16.在足量纯锌和稀硫酸的混合物中,滴加几滴下列溶液,产生氢气速率会增大,但是最终产生氢气总质量不变的是( )
| A. | 硫酸铜溶液 | B. | 较浓稀硫酸 | C. | 碳酸钠溶液 | D. | 硝酸银溶液 |
3. 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)上述反应是(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为65%.
(2)如图中表示NO2的变化的曲线是b,用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b,用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
20.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取绿矾(FeSO4•7H2O),设计了如下流程,下列说法不正确的是( )
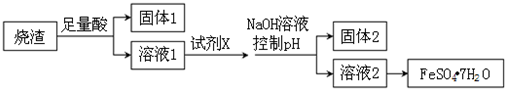

| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O | |
| D. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 |
18.下列说法中正确的是( )
| A. | 0.1mol•L-1的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| B. | 标准状况下,2.24L水的质量是1.8g | |
| C. | 16gO3比16gO2所含的氧原子数多 | |
| D. | 22gCO2与标准状况下11.2L Cl2含有相同的分子数 |
 下图是盐酸与氢氧化钠溶液的滴定曲线a和b.
下图是盐酸与氢氧化钠溶液的滴定曲线a和b.