题目内容
7. 实验室制取乙酸乙酯的主要步骤如下
实验室制取乙酸乙酯的主要步骤如下①在25mL的大试管A中按体积比2:3:2的比例配制浓硫酸、乙醇和乙酸的混合溶液.
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置分层.
④分离出乙酸乙酯层、洗涤、干燥.
以下数据可供参考:
| 物质 | 乙醇 | 乙酸 | 乙酸乙酯 | 浓硫酸 |
| 熔(℃) | -117.0 | 16.6 | -83.6 | ------ |
| 沸(℃) | 78.0 | 117.9 | 77.5 | 338.0 |
(1)配制该混合液试剂的添加顺序为:先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,冷却后再加冰醋酸.
(2)写出该反应的化学方程式:CH3COOH+CH3CH2OH
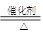 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.(3)该反应中哪些措施可以提高乙酸的转化率CD.
A.使用碎瓷片 B.酒精灯加热C.浓硫酸作吸水剂 D.将生成的乙酸乙酯蒸出
(4)上述实验中饱和碳酸钠溶液的主要是BCD(填字母)
A.加速酯的生成,提高其产率
B.降低乙酸乙酯的溶解度,便于液体分层
C.中和蒸出来的乙酸
D.吸收蒸出来的乙醇
(5)步骤②中需要小火均匀加热操作,其主要理由是:①温度过高可能发生其他副反应②减少乙酸乙醇的挥发.
(6)分离出乙酸乙酯层后,一般用饱和食盐水和饱和氯化钙溶液洗涤,通过洗涤出去碳酸钠、乙醇;为了干燥乙酸乙酯可选用的干燥剂为B(填字母).
A.浓硫酸 B.无水Na2SO4 C.碱石灰 D.NaOH固体.
分析 (1)浓硫酸密度大,应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水;
(3)提高乙酸的转化率,应该增大另一种反应物的浓度或减少生成物的浓度;
(4)根据乙酸的酸性和乙酸乙酯难溶于饱和碳酸钠分析;
(5)乙醇、乙酸的沸点较低,易挥发;
(6)干燥剂能吸收乙酸乙酯中的水分,但是不能与乙酸乙酯反应.
解答 解:(1)为防止酸液飞溅,应将密度大的液体加入到密度小的液体中,乙酸易挥发,冷却后再加入乙酸,
故答案为:先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,冷却后再加冰醋酸;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,方程式为:CH3COOH+CH3CH2OH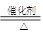 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
故答案为:CH3COOH+CH3CH2OH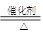 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(3)提高乙酸的转化率,应该增大另一种反应物的浓度,即增大乙醇的浓度,或减少生成物的浓度,即将生成的乙酸乙酯蒸出,或减少生成的水,即用浓硫酸吸水;
故答案为:CD;
(4)乙酸具有酸性,能和饱和碳酸钠溶液反应而把被吸收,吸收挥发的乙醇,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,易于分离;
故答案为:BCD;
(5)反应物中乙醇、乙酸的沸点较低,若用大火加热,大量反应物随产物蒸发而损失原料,温度过高还可能发生其他副反应,所以为防止乙醇、乙酸挥发,造成原料的损失,应小火加热,
故答案为:减少乙酸乙醇的挥发;
(6)干燥乙酸乙酯,用无水硫酸钠除去少量的水,无水硫酸钠吸水形成硫酸钠结晶水合物;不能选择浓硫酸、碱石灰和NaOH等固体干燥剂,以防乙酸乙酯在酸性或碱性条件下水解;
故答案为:B.
点评 本题主要考查了乙酸乙酯的制备,掌握乙酸乙酯的制备原理,以及运用原理理解实验装置的改进创新思路是解答的关键,题目难度中等,侧重于考查学生的分析能力和实验探究能力.

 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案| A. | 开发废旧电池综合利用技术,防止重金属盐对土壤水资源造成污染 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 倡导低碳生活,使用太阳能、风能等代替化石燃料,可减少温室气体的排放 | |
| D. | 垃圾是放错地方的资源,应分类回收利用 |
| A. | 50mL 3mol/L的KCl溶液 | B. | 30mL 1mol/L的NaCl溶液 | ||
| C. | 30mL 3mol/L的FeCl3溶液 | D. | 10mL3mol/L的AlCl3溶液 |

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
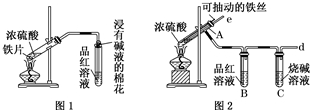 某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验.
某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验.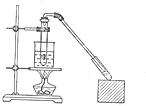 乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边搅动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上.
乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边搅动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上.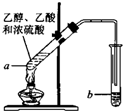 (1)在实验室可使用如图装置制取乙酸乙酯,请回答下列问题:
(1)在实验室可使用如图装置制取乙酸乙酯,请回答下列问题: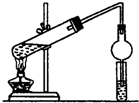 根据题目要求,回答下列问题:
根据题目要求,回答下列问题: CH3COOC2H5+H2O.装置中干燥管的作用是防止倒吸,小试管中的试剂为饱和碳酸钠溶液.
CH3COOC2H5+H2O.装置中干燥管的作用是防止倒吸,小试管中的试剂为饱和碳酸钠溶液.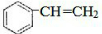 .在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为
.在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为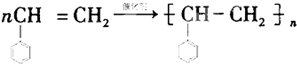 .A与氢气完全加成后产物的一氯代物共有5种.
.A与氢气完全加成后产物的一氯代物共有5种.