题目内容
1.要除去下表中所列有机物中的杂质(括号内为杂质),从(1)中选择适宜的试剂,从(2)中选择分离提纯的方法,用序号填入表中.(1)试剂:a.浓硫酸 b.氢氧化钠 c.生石灰 d.碳酸钠 e.水 f.浓溴水
方法:A.过滤 B.分液 C.蒸馏
| 要提纯的物质(杂质) | C2H5OH (H2O) | CH3CH2OH (CH3COOH) | C6H5Br (Br2) | C6H6 (C6H5OH) |
| 选用试剂(1) | c | b或d | b | b |
| 分离方法(2) | C | C | B | B |
分析 (1)CaO与水反应后,增大与乙醇的沸点差异;
乙酸与碳酸钠或NaOH反应后,增大与乙醇的沸点差异;
溴与NaOH反应后,与溴苯分层;
苯酚与NaOH溶液反应后,与苯分层;
(2)分液需要分液漏斗、烧杯等.
解答 解:(1)CaO与水反应后,增大与乙醇的沸点差异,然后蒸馏可分离;
乙酸与碳酸钠或NaOH反应后,增大与乙醇的沸点差异,然后蒸馏可分离;
溴与NaOH反应后,与溴苯分层,然后分液可分离;
苯酚与NaOH溶液反应后,与苯分层,然后可分液可分离,
故答案为:
| 要提纯的物质(杂质) | C2H5OH (H2O) | CH3CHO (CH3COOH) | C6H5Br (Br2) | C6H6 (C6H5OH) |
| 选用试剂(1) | c | b或d | b | b |
| 分离方法(2) | C | C | B | B |
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意有机物的性质及应用,题目难度不大.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
11.下列说法正确的是( )
| A. | 自来水出现水质污染物邻叔丁基苯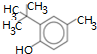 的分子式是C11H16O 的分子式是C11H16O | |
| B. | 有机物CH3CO18OH和C2H5OH在浓硫酸催化作用下产物为CH3CO18OC2H5和H2O | |
| C. | 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 | |
| D. | 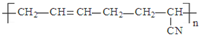 的单体是CH3-C≡C-CH3和CH2=CH-CN 的单体是CH3-C≡C-CH3和CH2=CH-CN |
9.简单离子Rn-的两个电子层都已充满,与Rn-电子数相同的简单离子(包含Rn-)通常共有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
16.某学生做元素性质递变实验时自己设计了一套方案,并记录了有关实验现象如表(实验方案与实验现象没对应)
请你帮助该同学完成实验报告:
(1)实验的目的探究同周期元素金属性的递变规律.
(2)实验仪器:①试管②酒精灯③胶头滴管④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等
(3)实验内容:
与实验方案1至5对应的实验现象依次为E、A、C、B、D(填字母编号).实验现象(A)为:钠浮在水面上,熔化化成小球,四处游动,发出嘶嘶响声,溶液变红.
(4)实验结论同周期元素从左到右金属性减弱.
| 实验方案 |
| 1.用砂纸打磨后的镁带加适量水加热,再向反应后溶液中滴加酚酞 |
| 2.钠与滴有酚酞试液的冷水反应 |
| 3.镁带与2mol/L的盐酸反应 |
| 4.铝条与2mol/L的盐酸反应 |
| 5.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
| 实验现象 |
| (A) |
| (B)反应不十分强烈,产生气体 |
| (C)剧烈反应,产生气体 |
| (D)生成白色胶状沉淀,然后沉淀消失 |
| (E)产生的气体可在空气中燃烧,溶液变成浅红色 |
(1)实验的目的探究同周期元素金属性的递变规律.
(2)实验仪器:①试管②酒精灯③胶头滴管④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等
(3)实验内容:
与实验方案1至5对应的实验现象依次为E、A、C、B、D(填字母编号).实验现象(A)为:钠浮在水面上,熔化化成小球,四处游动,发出嘶嘶响声,溶液变红.
(4)实验结论同周期元素从左到右金属性减弱.
13.某溶液可能含有NH4+、K+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种,现取100mL溶液先加入足量氯水,溶液呈无色,然后滴加足量BaCl2溶液,得到沉淀4.66g,在滤液中加足量NaOH溶液并加热,生成的气体在标准状况下体积为1.12L.
已知:SO32-+Cl2+H2O═SO42-+2Cl-+2H+;2Fe3++2I-═2Fe2++I2
根据上述实验,以下推测正确的是( )
已知:SO32-+Cl2+H2O═SO42-+2Cl-+2H+;2Fe3++2I-═2Fe2++I2
根据上述实验,以下推测正确的是( )
| A. | 原溶液一定存在NH4+、I- | |
| B. | 原溶液一定不含Ba2+、Fe3+、I- | |
| C. | 原溶液可能存在K+、Fe3+、SO42- | |
| D. | 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液所有的离子组成 |
 ,C和E形成化合物的电子式
,C和E形成化合物的电子式 .
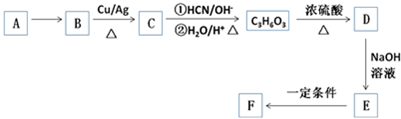
.
 ,CH3CH2OH$→_{△}^{浓硫酸}$CH2=CH2+H2O
,CH3CH2OH$→_{△}^{浓硫酸}$CH2=CH2+H2O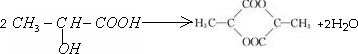 .
. ,F分子保水的原因-COONa 具有亲水性.
,F分子保水的原因-COONa 具有亲水性.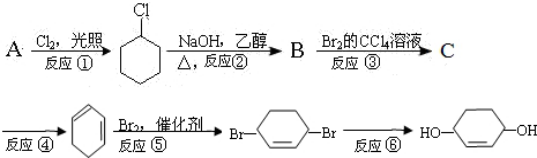
 .
.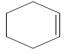 +Br2→
+Br2→ .
.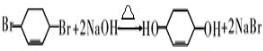 .
.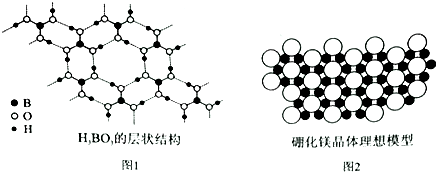 硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、复合材料等高新材料领域.
硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、复合材料等高新材料领域.