题目内容
16.设NA代表阿伏加德罗常数,下列说法中不正确的是( )| A. | 0.9g水中含有的电子数为NA | |
| B. | 常温常压下,0.2 NA个NH3分子的质量为3.4g | |
| C. | 14.0g由C2H4和C3H6组成的混合气体原子总数为3NA | |
| D. | 1 mol Na变为Na+时失去的电子数目为NA |
分析 A、求出水的物质的量,然后根据水中含10个电子来分析;
B、求出氨气的物质的量,然后根据质量m=nM来计算;
C、C2H4和C3H6的最简式均为CH2;
D、钠反应后变为+1价.
解答 解:A、0.9g水的物质的量n=0.05mol,而水中含10个电子,故0.05mol水中含0.5NA个电子,故A错误;
B、0.2NA个氨气分子的物质的量为0.2mol,故质量m=nM=0.2mol×17g/mol=3.4g,故B正确;
C、C2H4和C3H6的最简式均为CH2,故14g混合物中含有的CH2的物质的量为1mol,故含3NA个原子,故C正确;
D、钠反应后变为+1价,故1mol钠反应后失去NA个电子,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,掌握公式的运用和物质的结构是解题关键.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
6.等质量的氯气与下列足量物质反应,转移的电子数最少的是( )
| A. | SO2的水溶液 | B. | FeCl2溶液 | C. | 冷的NaOH溶液 | D. | Cu |
7.用括号内试剂除去下列各物质中的少量杂质,正确的是( )
| A. | 溴苯中的溴(苯) | |
| B. | MgCl2酸性溶液中少量的FeCl3(Mg(OH)2) | |
| C. | 硝基苯中的苯(硝酸) | |
| D. | 甲烷中的乙烯(酸性高锰酸钾溶液) |
11.参照反应Br+H2═HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
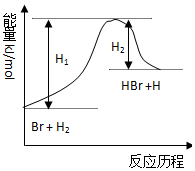

| A. | 正反应为放热反应 | |
| B. | 加入催化剂,该化学反应的反应热不改变 | |
| C. | 逆反应为吸热反应 | |
| D. | 加入催化剂可增大正反应速率,降低逆反应速率 |
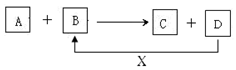 A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系.(图中反应条件略去)填写下列空白.
A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系.(图中反应条件略去)填写下列空白.