题目内容
已知在20℃时,每100g水溶解0.148g Ca(OH)2即达饱和.
(1)在20℃500g水中加入7.4g Ca(OH)2粉末,经充分搅拌后过滤,若液体体积仍为500mL,求OH-离子的物质的量浓度.
(2)若使原500mL溶液中的c(Ca2+)降低至0.01mol?L-1,求需要通入标准状况下二氧化碳气体多少升?
(1)在20℃500g水中加入7.4g Ca(OH)2粉末,经充分搅拌后过滤,若液体体积仍为500mL,求OH-离子的物质的量浓度.
(2)若使原500mL溶液中的c(Ca2+)降低至0.01mol?L-1,求需要通入标准状况下二氧化碳气体多少升?
考点:物质的量浓度的相关计算,化学方程式的有关计算
专题:计算题
分析:(1)根据氢氧化钙的溶解度可知,在20℃500g水中加入7.4g Ca(OH)2粉末溶解的氢氧化钙的质量,然后带入n=
、C=n?V计算;
(2)计算出反应掉的钙离子的物质的量,然后根据化学方程式进行求算.
| m |
| M |
(2)计算出反应掉的钙离子的物质的量,然后根据化学方程式进行求算.
解答:
解:(1)在20℃500g水中加入7.4g Ca(OH)2粉末溶解的氢氧化钙的质量为0.148g×
=0.74g,则所得饱和溶液的物质的量浓度为C=
=
=0.02mol/L,c(OH-)=2×0.02mol/L=0.04mol/L.
答:OH-离子的物质的量浓度为0.04mol/L.
(2)使原500mL溶液中的c(Ca2+)降低至0.01mol?L-1,钙离子反应的物质的量为:0.5L×0.01mol?L-1=0.005mol,设反应的二氧化碳的物质的量为xmol,则:
CO2+Ca 2++2OH-=CaCO3↓+H2O
1 1
xmol 0.005mol
因此xmol=0.005mol,
通入标准状况下二氧化碳气体V=n?Vm=0.005mol×22.4L/mol=0.112 L.
答:求需要通入标准状况下二氧化碳气体0.112升.
| 500 |
| 100 |
| n |
| V |
| ||
| 0.5L |
答:OH-离子的物质的量浓度为0.04mol/L.
(2)使原500mL溶液中的c(Ca2+)降低至0.01mol?L-1,钙离子反应的物质的量为:0.5L×0.01mol?L-1=0.005mol,设反应的二氧化碳的物质的量为xmol,则:
CO2+Ca 2++2OH-=CaCO3↓+H2O
1 1
xmol 0.005mol
因此xmol=0.005mol,
通入标准状况下二氧化碳气体V=n?Vm=0.005mol×22.4L/mol=0.112 L.
答:求需要通入标准状况下二氧化碳气体0.112升.
点评:本题考查了物质的量浓度、有关化学方程式的计算,题目难度中等,计算出溶解的氢氧化钙的质量是解题的关键.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
 右图小试管中盛有几毫升水,与大试管连通的U型细玻管内放有少量的水(已染成红色).如沿小试管壁小心地慢慢注入3mL浓硫酸,静置片刻后,U型细玻管中可观察到的液面现象是( )
右图小试管中盛有几毫升水,与大试管连通的U型细玻管内放有少量的水(已染成红色).如沿小试管壁小心地慢慢注入3mL浓硫酸,静置片刻后,U型细玻管中可观察到的液面现象是( )| A、左高右低 | B、左低右高 |
| C、左右一样高 | D、来回振动 |
下列命名或说法正确的是( )
A、 的名称是2,5,6-三甲基-4-乙基庚烷 的名称是2,5,6-三甲基-4-乙基庚烷 |
| B、常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 |
C、 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 |
| D、2,3-二甲基-1-丁烯 |
下列物质在水溶液中的电离方程式正确的是( )
| A、NaHSO4═Na++H++SO42- |
| B、KClO3═K++Cl5++3O2- |
| C、Ba(OH)2═Ba2++(OH)22- |
| D、H2SO4═H2++SO42- |
浓硫酸具有的性质是( )
| A、强的氧化性 | B、碱性 |
| C、还原性 | D、两性 |
 如图所示,某容器被分隔成A、B两部分.A容积固定不变,B有可移动的活塞.现向A中充入2mol SO2和1mol O2,向B中充入2mol SO3和1mol N2,在相同条件下发生可逆反应:2SO2+O2?2SO3(g).
如图所示,某容器被分隔成A、B两部分.A容积固定不变,B有可移动的活塞.现向A中充入2mol SO2和1mol O2,向B中充入2mol SO3和1mol N2,在相同条件下发生可逆反应:2SO2+O2?2SO3(g).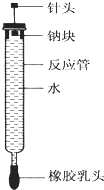 有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器略去).实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内.
有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器略去).实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内.