题目内容
把11g金属混合物加入足量的盐酸中生成5.6LH2(标况),此金属混合物的可能组成为( )
| A、镁、铁 | B、锌、铁 |
| C、铁、铜 | D、镁、钙 |
考点:有关混合物反应的计算
专题:
分析:设金属的化合价为+2价,根据n=
计算出标况下5.6L氢气的物质的量,然后根据M=
计算出金属的平均摩尔质量,再根据各选项进行判断,注意不反应的金属的摩尔质量可以看作无穷大.
| V |
| Vm |
| m |
| n |
解答:
解:标况下5.6L氢气的物质的量为:n(H2)=
=0.25mol,
该金属混合物的平均摩尔质量为:
=
=44g/mol,即金属的平均相对原子质量为44,
A.镁的相对原子质量为24,铁的相对原子质量为56,二者的平均相对原子量可以为44,故A正确;
B.锌的相对原子质量为65,铁的相对原子质量为56,二者的原子量都大于44,故B错误;
C.铁的相对原子质量为56,铜不与盐酸反应,所以二者的相对原子质量大于44,故C错误;
D.镁的相对原子质量为24,钙的相对原子质量为40,二者的相对原子质量都小于44,故D错误;
故选A.
| 5.6L |
| 22.4L/mol |
该金属混合物的平均摩尔质量为:
. |
| M |
| 11g |
| 0.25mol |
A.镁的相对原子质量为24,铁的相对原子质量为56,二者的平均相对原子量可以为44,故A正确;
B.锌的相对原子质量为65,铁的相对原子质量为56,二者的原子量都大于44,故B错误;
C.铁的相对原子质量为56,铜不与盐酸反应,所以二者的相对原子质量大于44,故C错误;
D.镁的相对原子质量为24,钙的相对原子质量为40,二者的相对原子质量都小于44,故D错误;
故选A.
点评:本题考查了有关混合金属与酸反应的计算,题目难度中等,注意掌握平均相对原子质量在化学计算中的应用方法,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列有关说法不正确的是( )
| A、产物乙酸乙酯存在18O |
| B、产物水中存在18O |
| C、反应中加入浓硫酸作催化剂 |
| D、此反应属于取代反应 |
一定条件下,在密闭容器中发生如下反应:CO(g)+2H2(g)?CH3OH(g),若开始时只充入a mol CH3OH蒸气,达到平衡时,混合物的压强比起始时增大了70%;若开始时充入a mol CO和2a mol H2的混合气体,达到平衡时H2的转化率为( )
| A、30% | B、35% |
| C、65% | D、70% |
下列叙述中,不正确的是( )
| A、天然气是以甲烷为主要成分的高效清洁燃料 |
| B、煤的干馏可得到煤焦油,通过煤焦油的分馏可获得各种芳香烃 |
| C、石油中含有烷烃和环烷烃,因此由石油不可能获得芳香烃 |
| D、通过石油的催化裂化及裂解可以得到轻质油和气态烯烃 |
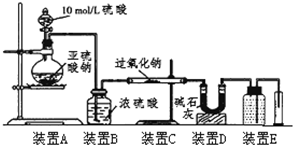 某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究.
某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究.