题目内容
16.在Cu+HNO3(稀)→Cu(NO3)2+NO↑+H2O 反应中,完成下列问题.(1)该反应中HNO3是氧化剂;Cu(NO3)2是氧化产物.
(2)该反应中硝酸表现了AC性.(选择填“A、氧化性 B、还原性 C、酸性”);
(3)该反应中有32g铜参加反应时,转移电子为NA个(用NA表示);被还原的HNO3与参加反应的HNO3的物质的量之比是1:2.
分析 Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O中,Cu元素的化合价升高,N元素的化合价降低,该反应转移2e-,以此来解答.
解答 解:(1)Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O中,N元素的化合价降低,HNO3为氧化剂,Cu元素的化合价升高,Cu为还原剂,硝酸铜是氧化产物,故答案为:HNO3;Cu(NO3)2;
(2)该反应中硝酸表现了酸性和氧化性,故选:AC;
(3)由反应可知,2mol硝酸作酸、2mol作氧化剂,则被还原的HNO3与参加反应的HNO3物质的量之比是1:2,当32gCu参加反应时,电子转移的物质的量是$\frac{32g}{64g/mol}$×(2-0)=1mol,所以转移电子为NA个,
故答案为:NA;1:2.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意利用化合价计算转移电子,题目难度不大.

练习册系列答案
相关题目
6.t℃时,AgCl 的 Ksp=2×10-10;Ag2CrO4是一种橙红色固体,在水中的沉淀溶解平衡曲 线如图所示.下列说法正确的是( )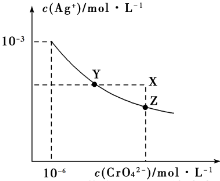

| A. | 在 t℃时,AgCl 的溶解度大于 Ag2CrO4 | |
| B. | 在 t℃时,Ag2CrO4的 Ksp=1×10-1210-3 | |
| C. | 在饱和 Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X 点 | |
| D. | 在 t℃时,用 AgNO3 标准溶液滴定 20mL 未知浓度的 KCl 溶液,不能采用K2CrO4溶液为指示剂 |
7.用等体积的0.1mol•L-1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
| A. | 3:2:3 | B. | 3:1:2 | C. | 2:6:3 | D. | 1:1:1 |
4.以下有关元素性质的说法不正确的是( )
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4原子半径最大的是① | |
| B. | 具有下列最外层电子排布式的原子中,①3s23p1②3s23p2 ③3s23p3 ④3s23p4第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ | |
| D. | 某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
11.根据“金刚石?石墨+1.896kJ”,可以得出的正确结论是( )
| A. | 石墨的能量比金刚石低 | B. | 石墨和金刚石都是碳的同位素 | ||
| C. | 金刚石转化为石墨是物理变化 | D. | 金刚石比石墨更稳定 |
8.用如图所示的装置进行实验,反应一段时间后断开K,向烧杯中加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH.下列说法中不正确的是( )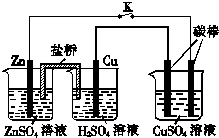

| A. | 铜棒为正极,其电极反应式为2H++2e-=H2↑ | |
| B. | 烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应中消耗锌的质量为6.5 g | |
| D. | 导线中通过电子的物质的量为0.1 mol |
5.元素X的原子,其M层与K层电子数相同;元素Y的原子,其M层上有7个电子.X和Y所形成的稳定化合物的相对分子质量为( )
| A. | 100 | B. | 95 | C. | 88 | D. | 80 |
6.物质的量浓度相同的下列溶液中,c(NH4+)最大的是( )
| A. | NH4Cl | B. | (NH4)2SO4 | C. | NH4HSO4 | D. | NH4HCO3 |