题目内容
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
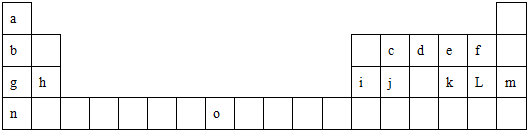
试回答下列问题:
(1)请写出元素O的基态原子电子排布式 .
(2)第三周期8种元素按单质熔点高低的顺序排布如图1,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图中的序号)
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是 (填化学式),试从结构角度加以解释: .
(4)k L2的电子式是 ,它在常温下呈液态,形成晶体时,属于 晶体.
(5)i单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图2乙所示,原子之间相互位置关系的平面图如图2丙所示.
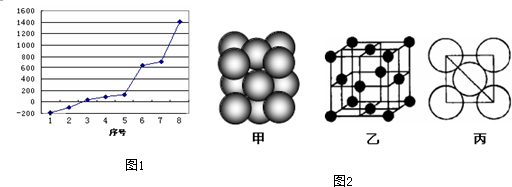
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
晶胞中i原子的配位数为 ,一个晶胞中i原子的数目为 ,该晶体的密度为 (用M、NA、d表示)

试回答下列问题:
(1)请写出元素O的基态原子电子排布式
(2)第三周期8种元素按单质熔点高低的顺序排布如图1,其中序号“8”代表
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
(4)k L2的电子式是
(5)i单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图2乙所示,原子之间相互位置关系的平面图如图2丙所示.

若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
晶胞中i原子的配位数为
考点:元素周期律和元素周期表的综合应用,晶体的类型与物质熔点、硬度、导电性等的关系,晶胞的计算
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:(1)由元素在周期表中的位置可知,元素o处于第四周期第Ⅷ族,元素周期表中第26号元素,为Fe元素,根据核外电子排布规律书写;
(2)由图可知,序号“8”代表的物质熔点最高,第三周期中有原子晶体Si,熔点最高;同周期自左而右电负性增强,第三周期中Cl元素的电负性最大,氯气常温下为气体,比氩气的相对分子质量大,熔点仅高于氩气;
(3)由元素在周期表中的位置可知,j是Si元素,c是C元素,二者形成难熔的晶体为SiC,为原子晶体,利用共价键来分析熔点高低;
(4)根据K元素为S元素,L为Cl元素可知KL2为SCl2,共价化合物,写出电子式;根据常温为液态来分析晶体类型;
(5)由图可知,晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用;根据均摊法计算晶胞中含有原子数目;
由图丙可知,正方形对角线长度为4d cm,故立方体的棱长为,
×4dcm=2
d cm,晶胞体积为(2
dcm)3=16
d3cm3,根据晶胞含有原子数目计算晶胞的质量,再根据ρ=
计算密度.
(2)由图可知,序号“8”代表的物质熔点最高,第三周期中有原子晶体Si,熔点最高;同周期自左而右电负性增强,第三周期中Cl元素的电负性最大,氯气常温下为气体,比氩气的相对分子质量大,熔点仅高于氩气;
(3)由元素在周期表中的位置可知,j是Si元素,c是C元素,二者形成难熔的晶体为SiC,为原子晶体,利用共价键来分析熔点高低;
(4)根据K元素为S元素,L为Cl元素可知KL2为SCl2,共价化合物,写出电子式;根据常温为液态来分析晶体类型;
(5)由图可知,晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用;根据均摊法计算晶胞中含有原子数目;
由图丙可知,正方形对角线长度为4d cm,故立方体的棱长为,
| ||
| 2 |
| 2 |
| 2 |
| 2 |
| m |
| V |
解答:
解:(1)由元素在周期表中的位置可知,元素o处于第四周期第Ⅷ族,为26号元素Fe,原子核外有26个电子,根据构造原理其核外电子排布式为:1s22s22p63s23p63d64s2,
故答案为:1s22s22p63s23p63d64s2;
(2)由图可知,序号“8”代表的物质熔点最高,第三周期中有原子晶体Si,熔点最高,同周期自左而右电负性增强,第三周期中Cl元素的电负性最大,氯气常温下为气体,比氩气的相对分子质量大,熔点仅高于氩气,故2代表氯元素,
故答案为:Si;2;
(3)c是C元素,j是Si元素,二者形成难熔的晶体为SiC,为原子晶体,因Si-Si键的键长大于Si-C键的键长,则SiC中键能大,熔点高,
故答案为:SiC;Si-Si键的键长大于Si-C键的键长,则SiC中键能大,熔点高;
(4)根据K元素为S元素,L为Cl元素可知KL2为SCl2,为共价化合物,电子式为: ;由于SCl2在常温下为液态,故为分子晶体,故答案为:
;由于SCl2在常温下为液态,故为分子晶体,故答案为: ;分子;
;分子;
(5)根据图片知,Al单质为面心立方最密堆积,Al原子配位数配位数=3×
×8=12,由图2可知占据顶点和面心,则个数为8×
+6×
=4;
由图丙可知,正方形对角线长度为4d cm,故立方体的棱长为:
×4dcm=2
d cm,晶胞体积为(2
dcm)3=16
d3cm3,
晶胞中含有原子数目=8×
+6×
=4,相对原子质量为M,故晶胞的质量=4×
g,故晶体的密度=
g/cm3=
g/cm3,
故答案为:12;4;
g/cm3;
故答案为:1s22s22p63s23p63d64s2;
(2)由图可知,序号“8”代表的物质熔点最高,第三周期中有原子晶体Si,熔点最高,同周期自左而右电负性增强,第三周期中Cl元素的电负性最大,氯气常温下为气体,比氩气的相对分子质量大,熔点仅高于氩气,故2代表氯元素,
故答案为:Si;2;
(3)c是C元素,j是Si元素,二者形成难熔的晶体为SiC,为原子晶体,因Si-Si键的键长大于Si-C键的键长,则SiC中键能大,熔点高,
故答案为:SiC;Si-Si键的键长大于Si-C键的键长,则SiC中键能大,熔点高;
(4)根据K元素为S元素,L为Cl元素可知KL2为SCl2,为共价化合物,电子式为:
 ;由于SCl2在常温下为液态,故为分子晶体,故答案为:
;由于SCl2在常温下为液态,故为分子晶体,故答案为: ;分子;
;分子;(5)根据图片知,Al单质为面心立方最密堆积,Al原子配位数配位数=3×
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
由图丙可知,正方形对角线长度为4d cm,故立方体的棱长为:
| ||
| 2 |
| 2 |
| 2 |
| 2 |
晶胞中含有原子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| M |
| NA |
| ||
16
|
| M | ||
4
|
故答案为:12;4;
| M | ||
4
|
点评:本题考查物质结构与性质、元素周期律、核外电子排布、晶胞结构与计算等,注意对电离能突变的理解,晶胞计算需要学生具有一定的数学计算能力与空间想象力,难度中等.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
下列各项中的物质,能满足如图中阴影部分关系的是( )


| ① | ② | ③ | ④ | |
| A | NaCl | Na2SO4 | KCl | Mg(NO3)2 |
| B | Na2SO4 | K2SO4 | KCl | MgCl2 |
| C | NaCl | K2SO4 | KCl | MgCl2 |
| D | Na2SO4 | K2SO4 | KCl | Mg(NO3)2 |
| A、A | B、B | C、C | D、D |
室温时,关于溶液的下列说法正确的是( )
| A、c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 | ||
| B、水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 | ||
C、往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中
| ||
| D、等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3⑤NH4HCO3中c(CO32-)的大小关系为:②>④>③>⑤>① |
配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的是( )
| A、称重时发现砝码生锈 |
| B、定容时观察液面俯视 |
| C、有少量NaOH溶液残留在烧杯中 |
| D、容量瓶中原来有少量的蒸馏水 |

 为原料,合成
为原料,合成 ,写出合成流程图(无机试剂任用).合成
,写出合成流程图(无机试剂任用).合成 某小组利用H2C204溶液和酸性KMn04溶液反应来探究“条件对化学反应速率的影响”.
某小组利用H2C204溶液和酸性KMn04溶液反应来探究“条件对化学反应速率的影响”.