题目内容
 某小组利用H2C204溶液和酸性KMn04溶液反应来探究“条件对化学反应速率的影响”.
某小组利用H2C204溶液和酸性KMn04溶液反应来探究“条件对化学反应速率的影响”.(1)向酸性KMn04溶液中加入一定量的H2C204溶液,当溶液中的KMn04耗尽后,紫色溶液将褪去.为确保能观察到紫色褪去,H2C204与KMn04初始的物质的量需要满足的关系为n(H2C204):n(KMnO4)
(2)为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案
下实验方案
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMnO4溶液 | H2O | ||
| V/mL | c/(mol?L-1) | V/mL | c/(mol?L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
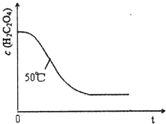
(3)已知50°C时,浓度c(H2C204)随反应时间t的变化曲线如图示,若保持其他条件不变,请在答题卡坐标图中画出25°C时c(H2C204)随t的变化曲线示意图.
考点:探究影响化学反应速率的因素
专题:实验设计题
分析:(1)根据化合价升降相等,来配平即可得出答案;
(2)研究反应物浓度对化学反应速率的影响,其条件不变的情况下只改变温度;
(3)根据温度降低反应速率减小画出25℃时c(MnO4-)~t的变化曲线示意图.
(2)研究反应物浓度对化学反应速率的影响,其条件不变的情况下只改变温度;
(3)根据温度降低反应速率减小画出25℃时c(MnO4-)~t的变化曲线示意图.
解答:
解:(1)H2C204中碳由+3价变为+4价,升高1×2;而锰由+7变为+2,降低5价;升降守恒,所以最小公倍数为5;即n(H2C204):n(KMnO4)≥2.5,故答案为:≥2.5;
(2)只改变草酸的浓度,而混合溶液的体积不变,进行对照试验,探究浓度对反应速率的影响,实验①溶液的体积是13mL,所以x=2ml,故答案为:2;保证其它条件不变,只改变H2C2O4的浓度,从而达到对比的目的;
(3)25℃时反应速率小于50℃时,所以高锰酸根离子的浓度变化比50℃时小,反应需要的时间大于50℃条件下需要的时间,据此画出25℃时c(MnO4-)~t的变化曲线示意图为: ,故答案为:
,故答案为: .
.
(2)只改变草酸的浓度,而混合溶液的体积不变,进行对照试验,探究浓度对反应速率的影响,实验①溶液的体积是13mL,所以x=2ml,故答案为:2;保证其它条件不变,只改变H2C2O4的浓度,从而达到对比的目的;
(3)25℃时反应速率小于50℃时,所以高锰酸根离子的浓度变化比50℃时小,反应需要的时间大于50℃条件下需要的时间,据此画出25℃时c(MnO4-)~t的变化曲线示意图为:
 ,故答案为:
,故答案为: .
.
点评:侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,难度稍大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
已知某溶液中只存在OH-、H+、Cl-、NH4+四种离子,其离子浓度可能有如下关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)②c(Cl-)>c(NH4+)>c(OH-)>c(OH+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)④c(NH4+)=c(Cl-)>c(OH-)=c(H+)
下列说法正确的是( )
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)②c(Cl-)>c(NH4+)>c(OH-)>c(OH+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)④c(NH4+)=c(Cl-)>c(OH-)=c(H+)
下列说法正确的是( )
| A、若①正确,则溶液中溶质一定为NH4Cl |
| B、若③正确,则溶液中c(NH3?H2O)+c(NH4+)>c(Cl-) |
| C、若④正确,且该溶液是由盐酸和氨水等体积混合而成,则盐酸中c(H+)等于氨水中c(OH-) |
| D、上述四种关系式均可能成立 |
某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是( )
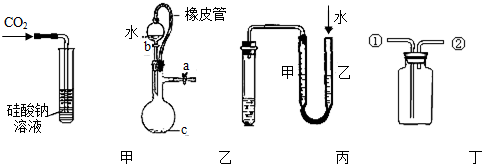

| A、甲装置:可用来证明碳的非金属性比硅强 |
| B、乙装置:橡皮管的作用是能使水顺利流下 |
| C、丙装置:用图示的方法不能检查此装置的气密性 |
| D、丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集一氧化氮 |
下列反应的离子方程式正确的是( )
| A、铝与NaOH溶液反应:2Al+2 OH-+2H2O═2 AlO2-+3H2↑ |
| B、铁与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ |
| C、向AlCl3溶液中滴入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ |
| D、Na与水反应:Na+2H2O═Na++2OH-+H2↑ |
分子式为C5H11Cl的卤代烃,其分子中含有两个-CH3,两个-CH2-,一个
-和一个-Cl,他可能的结构有( )
| CH |
| | |
| A、2种 | B、3种 | C、4种 | D、5种 |
下列有关物质的应用不正确的是( )
| A、碳酸氢钠具有弱碱性,可治疗胃酸过多 |
| B、氧化镁熔点高,可做耐高温材料 |
| C、二氧化硫具有漂白性,可用于漂白纸浆和草帽辫 |
| D、二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |