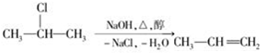题目内容
下列溶液的溶质都是强电解质,这些溶液中的Cl-浓度与50mL 1mol?L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A、150 mL 1 mol?L-1 NaCl溶液 |
| B、75 mL 1 mol?L-1CaCl2溶液 |
| C、150 mL 2 mol?L-1 KCl溶液 |
| D、75 mL 1 mol?L-1AlCl3溶液 |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:离子的物质的量浓度与溶液的浓度和溶质的化学式有关,氯离子的浓度=溶液的浓度×化学式中氯离子个数,与溶液体积无关.
解答:
解:50.0mL l.0mol?L-1CaCl2溶液中的Cl-浓度为1mol/L×2=2mol/L,
A、150.0mL 1.0mo1.L-1NaCl溶液中氯离子的浓度为1mol/L,与题意不符,故A错误;
B、75.0mL 1.0 mol?L-1CaCl2溶液中氯离子的浓度为1mol/L×2=2mol/L,与题意相符,故B正确;
C、150.0mL 2.0mo1.L-1KCl溶液中氯离子的浓度为2mol/L,与题意相符,故C正确;
D、75.0 mL 1.0mol?L-1A1C13溶液中氯离子的浓度为1mol/L×3=3mol/L,与题意不符,故D错误;
故选BC.
A、150.0mL 1.0mo1.L-1NaCl溶液中氯离子的浓度为1mol/L,与题意不符,故A错误;
B、75.0mL 1.0 mol?L-1CaCl2溶液中氯离子的浓度为1mol/L×2=2mol/L,与题意相符,故B正确;
C、150.0mL 2.0mo1.L-1KCl溶液中氯离子的浓度为2mol/L,与题意相符,故C正确;
D、75.0 mL 1.0mol?L-1A1C13溶液中氯离子的浓度为1mol/L×3=3mol/L,与题意不符,故D错误;
故选BC.
点评:本题考查了溶液中离子浓度的计算,明确溶液中离子的浓度=溶液的浓度×化学式中离子个数是解本题的关键,难度不大.

练习册系列答案
相关题目
按如图所示装置进行实验(其中C1、C2均是石墨电极),下列说法中错误的是( )

| A、在标准状况下,Zn极减轻3.25 g时,Cu极上放出气体体积约为1.12 L |
| B、发现a点附近显红色 |
| C、在C1、C2电极所产生气体的体积比为2:1 |
| D、乙池溶液的pH减小 |
X、Y、Z均为第三周期元素,X的第一电离能在同周期中最小,Y的电负性在同周期中最大,Z的离子半径在同周期中最小,下列关于X、Y、Z叙述中不正确的是( )
| A、元素Y形成的气态氢化物水溶液呈强酸性 |
| B、元素X与元素Y能形成离子化合物 |
| C、元素Z最高价氧化物对应水化物具有两性 |
| D、离子半径大小顺序均为:X>Y>Z |
完全燃烧相同质量的下列各烃,消耗氧气最多的是( )
| A、C3H4 |
| B、C2H4 |
| C、CH4 |
| D、C3H6 |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温常压下,3gCO和25gN2组成的混合气体中所含原子总数为2NA |
| B、标准状况下11.2L CCl4中所含共价键数目为2NA |
| C、在100mL 1mol/L的Na2CO3溶液中,含有的CO32-数目为0.1NA |
| D、2molSO2、1molO2充分反应后,转移电子数为4NA |
下列离子方程式正确的是( )
| A、向NaAlO2溶液中通入足量的CO2气体:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| B、向FeSO4酸性溶液中加入过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O |
| C、向溴水中通入SO2气体:SO2+Br2+2H2O=2H++SO42-+2HBr |
| D、FeS加入稀硫酸中:S2-+2H+=H2S |