题目内容
13. 工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.
工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.(1)工业上处理100L Cr2O72-含量为108mg•L-1的含铬废水,至少需要3.36L(标准状况)SO2.
(2)已知:Ksp[Cr(OH)3]=1×10-30.室温下,除去被SO2还原所得溶液中的Cr3+(使其浓度小于1×10-6 mol•L-1),需调节溶液pH>6.
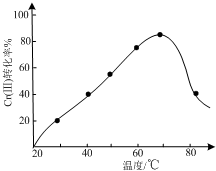
(3)三价铬Cr(Ⅲ)与双氧水反应可用于合成铬黄(PbCrO4).控制其他条件不变,调节反应温度,考察反应温度对Cr(Ⅲ)转化率的影响(如图所示).温度超过70℃时,Cr(Ⅲ)转化率下降的原因是较高温度下双氧水分解.
(4)光照下,草酸(H2C2O4)也能将Cr2O72-转化为Cr3+.化学式为Al2Fe(SO4)4的某发盐(毛发状,在空气中能被氧化)对该反应具有催化作用.为确定一瓶久置发盐的化学成分,学习小组进行如下实验:
取一定质量的发盐样品溶于足量的稀硫酸中,将溶液分为两等份.其中一份与酸性KMnO4溶液充分反应(反应后MnO4-被还原成Mn2+),消耗浓度为0.4000mol•L-1的KMnO4溶液20.00mL;往另一份溶液中加入足量稀氨水,在空气中微热并搅拌使之充分反应,待沉淀不再变化后过滤,将沉淀洗涤并充分灼烧后称量,得9.100g干燥固体粉末.
通过计算与合理猜想,推测该久置发盐的可能化学组成(请给出计算过程与推测理由).
分析 (1)由Cr2O72-~2Cr3+~6e-,SO2~SO42-~2e-,可得Cr2O72-~3SO2,根据关系式计算;
(2)根据Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1×10-30计算c(OH-),再结合水的离子积计算c(H+),根据pH=-lgc(H+)计算;
(3)温度升高过氧化氢分解平衡逆向进行;
(4)n(KMnO4)=0.4000mol/L×20ml×10-3L/ml=8.000×10-3mol,
n(Fe2+)=5×8.000×10-3mol=0.04000mol,依据发盐的化学式可知在久置的发盐中n(Al3+)=2×[0.04000mol+n(Fe3+)],
加入氨水后生成的干燥固体粉末中:
n(Al2O3)=0.04000mol+n(Fe3+)
n(Fe2O3)=$\frac{1}{2}$[0.04000mol+n(Fe3+)]
102g/mol×[0.04000mol+n(Fe3+)]+160g/mol×$\frac{1}{2}$×[0.04000mol+n(Fe3+)]=9.10g
n(Fe3+)=001000mol
n(Al3+)=2×[0.04000mol+n(Fe3+)]=0.1000mol
n(SO42-)=2n(Al3+)=0.2000mol
久置的发盐中的阳离子所带电荷总数:3n(Al3+)+2n(Fe2+)+3n(Fe3+)=0.4100mol
而已知的阴离子所带电荷总数2n(SO42-)=0.4000mol<0.4100mol,由于发盐在空气中被氧化,故其中还可能存在0.01000molOH-或0.00500molCO32-,据此书写化学式.
解答 解:(1)100LCr2O72-含量为108mg•L-1的含铬废水中含Cr2O72-物质的质量=100L×108mg•L-1的=10800mg=10.8g,物质的量n(Cr2O72-)=$\frac{10.8g}{216g/mol}$=0.05mol,
根据电子转移守恒:Cr2O72-~3SO2~6e-;
1 3
0.05mol n
所以n=0.15mol,
标准状况下体积=22.4L/mol×0.15mol=3.36L,
故答案为:3.36;
(2)室温下,除去被SO2还原所得溶液中的Cr3+(使其浓度小于1×10-6mol•L-1),Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1×10-30,则c(OH-)=10-8mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-8}}$=10-6mol/L,则pH=6,需调节溶液pH>6,
故答案为:>6;
(3)三价铬Cr(Ⅲ)与双氧水反应可用于合成铬黄(PbCrO4),发生的是氧化还原反应,图象分析可知反应达到平衡状态达到最大转化率,温度升高超过70℃时过氧化氢分解,使平衡逆向进行,Cr(Ⅲ)转化率下降,
故答案为:较高温度下双氧水分解;
(4)n(KMnO4)=0.4000mol/L×20ml×10-3L/ml=8.000×10-3mol,
n(Fe2+)=5×8.000×10-3mol=0.04000mol,依据发盐的化学式可知在久置的发盐中n(Al3+)=2×[0.04000mol+n(Fe3+)],
加入氨水后生成的干燥固体粉末中:
n(Al2O3)=0.04000mol+n(Fe3+)
n(Fe2O3)=$\frac{1}{2}$[0.04000mol+n(Fe3+)]
102g/mol×[0.04000mol+n(Fe3+)]+160g/mol×$\frac{1}{2}$×[0.04000mol+n(Fe3+)]=9.10g
n(Fe3+)=001000mol
n(Al3+)=2×[0.04000mol+n(Fe3+)]=0.1000mol
n(SO42-)=2n(Al3+)=0.2000mol
久置的发盐中的阳离子所带电荷总数:3n(Al3+)+2n(Fe2+)+3n(Fe3+)=0.4100mol
而已知的阴离子所带电荷总数2n(SO42-)=0.4000mol<0.4100mol,由于发盐在空气中被氧化,故其中还可能存在0.01000molOH-或0.00500molCO32-,
该发盐的可能组成为n(Al3+):[n(Fe2+)+n(Fe3+)]:n(OH-):n(SO42-)=0.1:0.05:0.01:0.2=10:5:1:20,化学式为:Al10Fe5(OH)(SO4)20,
n(Al3+):[n(Fe2+)+n(Fe3+)]:n(CO32-):n(SO42-)=0.1:0.05:0.005:0.2=20:10:1:40,化学式为Al20Fe10(CO3)(SO4)40,
答:该久置发盐的可能化学组成为Al10Fe5(OH)(SO4)20或Al20Fe10(CO3)(SO4)40.
点评 本题考查物质组成的实验探究、溶度积常数计算、化学式计算应用、氧化还原反应定量计算的分析判断,掌握基础是解题关键,题目难度较大.

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案| A. | 原电池中电子流出的一极是正极 | |
| B. | 原电池是将化学能转变为电能的装置 | |
| C. | 构成原电池的正极和负极必须是两种不同的金属 | |
| D. | 原电池放电时,电流的方向是从负极到正极 |
| A. | 无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl- | |
| D. | 紫色石蕊试液呈红色的溶液中:Ca2+、Cl-、Na+、HCO3- |
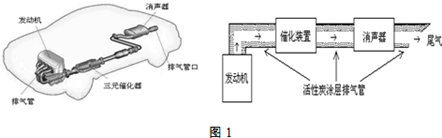
(1)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1,其能量变化示意图如下:
则NO中氮氧键的键能为632kJ•mol-1;
(2)空燃比过小易产生CO.有人提出可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染.判断该设想是否可行,并说出理由不合理,该反应焓增、熵减,任何条件下都不能自发进行或该反应△H>0,△S<0 则△G>0;
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=-b kJ•mol-1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是AD;
A.增加排气管长度 B.增大尾气排放口
C.升高排气管温度 D.添加合适的催化剂
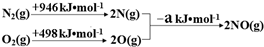
(4)催化装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到图2所示的曲线.催化装置比较适合的温度和压强是400K,1MPa;
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s 内,CO和NO百分含量没明显变化的原因是尚未达到催化剂工作温度(或尚未达到反应的温度);
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了以下三组实验:
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ⑨ | ④ | ⑤ | ⑩ | ⑥ | ⑦ | ⑧ |
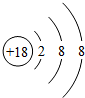 ;
;(2)表中金属性最强的元素是Na(用元素符号表示,下同),非金属性最强的元素是F,可作半导体材料的是Si元素的单质;
(3)表中能形成两性氢氧化物的元素是Al,写出该元素的单质与⑨的最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(4)⑨的最高价氧化物的水化物所含化学键类型离子键、共价键;
(5)①、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式);
(6)元素①的最高价氧化物的电子式
 ,④元素与⑦元素形成化合物的电子式
,④元素与⑦元素形成化合物的电子式 .
. | A. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| B. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 | |
| C. | 石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化 | |
| D. | 合金超导材料是指熔合两种或两种以上的金属元素并形成具有超导电性的超导材料,如铌一钛(Nb-Ti)合金,通常它的熔点一般比纯钛要高. |
| A. | 20℃铁片 1mol/L硫酸 | B. | 30℃铁粉 1mol/L硫酸 | ||
| C. | 30℃铁粉 2mol/L硫酸 | D. | 30℃铁片 18mol/L硫酸 |