题目内容
有关AgCl沉淀的溶解平衡的说法正确的是( )
| A、AgCl沉淀的生成和溶解在达到平衡时就不再进行 |
| B、AgCl不溶于水,溶液中没有Cl-和Ag+ |
| C、升高温度,AgCl的溶解度增大,Ksp增大 |
| D、向AgCl饱和溶液中加入NaCl固体,AgCl的溶解度和Ksp都不变 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:A、沉淀溶解平衡是动态平衡;
B、AgCl难溶于水,溶解度很小,但是不为零;
C、升高温度氯化银溶解度增大;
D、溶解度只与温度有关.
B、AgCl难溶于水,溶解度很小,但是不为零;
C、升高温度氯化银溶解度增大;
D、溶解度只与温度有关.
解答:
解:A、达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,是动态平衡,速率相等但是不为零,故A错误;
B、AgCl难溶于水,溶解度很小,但是不为零,所以溶液中含有少量的Ag+和Cl-,故B错误;
C、升高温度会增大AgCl的溶解,所以氯化银溶解度会增大,Ksp增大,故C正确;
D、加入NaCl固体,氯离子浓度增大,沉淀溶解平衡逆向进行,会析出AgCl固体,AgCl的溶解度减小,Ksp不变,故D错误;
故选C.
B、AgCl难溶于水,溶解度很小,但是不为零,所以溶液中含有少量的Ag+和Cl-,故B错误;
C、升高温度会增大AgCl的溶解,所以氯化银溶解度会增大,Ksp增大,故C正确;
D、加入NaCl固体,氯离子浓度增大,沉淀溶解平衡逆向进行,会析出AgCl固体,AgCl的溶解度减小,Ksp不变,故D错误;
故选C.
点评:本题主要考查了沉淀溶解平衡的影响因素和平衡移动方向,物质溶解度的变化应用,题目较简单,平时注意认真总结.

练习册系列答案
相关题目
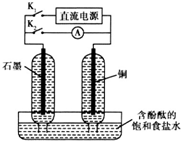 某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )
某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )| A、断开K2,闭合K1时,铜电极为阳极 |
| B、断开K2,闭合K1时,石墨电极附近溶液变红 |
| C、断开K1,闭合K2时,铜电极发生还原反应 |
| D、断开K1,闭合K2时,石墨电极作正极 |
配制100mL1mol/L的氢氧化钠溶液,下列操作错误的是( )
| A、在托盘天平上放两片大小相同的纸,然后将氢氧化钠放在纸上称取 |
| B、把称得的氢氧化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,再把溶液转入容量瓶中 |
| C、用蒸馏水洗涤烧杯、玻棒2~3次,洗涤液也移入容量瓶 |
| D、沿着玻棒往容量瓶中加蒸馏水,直至溶液凹面的最低点与刻度相切 |
在一个6L的密闭容器内,通入2LX(气)和2LY(气),在一定条件下发生反应:4X(气)+3Y(气)?2Q(气)+nR(气).达平衡后,容器内温度不变,混合气体的压强比原来增大了5%,X的浓度减小到
,则该反应方程式中的n值是( )
| 1 |
| 3 |
| A、3 | B、4 | C、5 | D、6 |
a g Al2O3和CuO组成的混合物全部溶于20mL、物质的量浓度为0.1mol/L的盐酸中,反应后向所得溶液中加入10mL NaOH溶液,恰好使Cu2+、Al3+完全沉淀,则氢氧化钠溶液的物质的量浓度为( )
| A、0.1mol/L |
| B、0.2 mol/L |
| C、0.4mol/L |
| D、0.8mol/L |
 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组用甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示:
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组用甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示: