题目内容
12.用石墨作电极电解1mol•L-1下列物质的溶液,一段时间后溶液的pH增大的是( )①H2SO4 ②NaOH ③Na2SO4 ④NaCl.
| A. | 只有① | B. | ②④ | C. | ①②④ | D. | ①②③④ |
分析 用石墨作电极电解1mol•L-1下列物质的溶液,一段时间后溶液的pH增大,说明电解后溶液中c(H+)减小或c(OH-)增大,溶液中溶质可能是可溶性强碱、活泼金属的无氧酸盐等,据此分析解答.
解答 解:①用惰性电极电解H2SO4溶液时,阳极上氢氧根离子放电、阴极上氢离子放电,所以相当于电解水,电解过程中硫酸浓度增大,导致溶液的pH减小,故错误;
②用惰性电极电解NaOH溶液时,阳极上氢氧根离子放电、阴极上氢离子放电,相当于电解水,导致NaOH浓度增大,溶液的pH增大,故正确;
③用惰性电极电极Na2SO4溶液时,阳极上氢氧根离子放电、阴极上氢离子放电,相当于电解水,导致硫酸钠浓度增大,但硫酸钠是强酸强碱盐,其溶液呈中性,所以溶液的pH不变,故错误;
④用惰性电极电解NaCl溶液时,阴极上氢离子放电、阳极上氯离子放电,所以电解后溶液中溶质含有NaOH,溶液中c(OH-)增大,pH增大,故正确;
故选B.
点评 本题考查电解原理,为高频考点,明确各个电极上放电离子是解本题关键,熟练掌握常见离子放电顺序,知道电解前后溶液中溶质及其浓度变化,题目难度不大.

练习册系列答案
相关题目
2.下列各物质中,化学键类型不同的是( )
| A. | H2O、CO | B. | MgF2、H2O2 | C. | KOH、Mg(OH)2 | D. | HCl、H2SO4 |
3.下列有关电化学原理的说法中,错误的是( )
| A. | Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,铅为负极,PbO2为正极 | |
| B. | 电解氯化铜溶液,Cu2+向阴极迁移 | |
| C. | 氯碱工业中电解氯化钠溶液阴极产物为氯气 | |
| D. | 可充电的电池称“二次电池”,在充电时.是将电能转变成化学能,在放电时,又将化学能转化成电能 |
20.对于可逆反应:2NO2(g)?N2O4(g)正反应放热.下列判断正确的是( )
| A. | 升高温度,混合气体颜色变浅 | |
| B. | 平衡时,NO2浓度必定等于N2O4浓度的两倍 | |
| C. | 平衡时,反应不在进行 | |
| D. | 平衡时,各组分浓度不再随时间的延长而发生变化 |
17.下列说法或表示方法正确的是( )
| A. | 将0.5molN2和1.5molH2充入一密闭容器中充分反应,放出热量19.6KJ则该热化学方程式为N2(g)+3 H2(g)?2NH3(g)△H=-39.2 KJ•mol-1 | |
| B. | 由C(石墨)=C(金刚石);△H=+1.9 kJ/mol,可知金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 | |
| D. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol |
4.用萃取法从碘水中分离碘,所用萃取剂应具有的性质是( )
①不和碘或水起化学反应 ②能溶于水 ③不溶于水 ④应是极性溶剂 ⑤应是非极性溶剂.
①不和碘或水起化学反应 ②能溶于水 ③不溶于水 ④应是极性溶剂 ⑤应是非极性溶剂.
| A. | ①②⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①③④ |
1.下表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
(1)由实验可推知,反应物的总能量>产物的总能量(填“<”“>”“=”).
(2)实验4和5表明,固体的表面积 对反应速率有影响,固体的表面积越大 反应速率越快,能表明同一规律的实验还有1、2(填实验序号);
(3)仅表明反应物浓度对反应速率产生影响的实验有1、3、4、6、8 或 2、5 (填实验序号);
(4)本实验中影响反应速率的其他因素还有溶液的温度,其实验序是6和7.
| 实验序号 | 金属质量/g | 金属状态 | c(H2SO4)/mol.L-1 | v(H2SO4)/mL | 溶液温度反应前/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
(1)由实验可推知,反应物的总能量>产物的总能量(填“<”“>”“=”).
(2)实验4和5表明,固体的表面积 对反应速率有影响,固体的表面积越大 反应速率越快,能表明同一规律的实验还有1、2(填实验序号);
(3)仅表明反应物浓度对反应速率产生影响的实验有1、3、4、6、8 或 2、5 (填实验序号);
(4)本实验中影响反应速率的其他因素还有溶液的温度,其实验序是6和7.
3.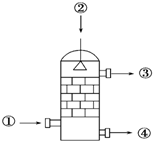 在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )
在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )
 在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )
在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环.下列说法中不正确的是( )| A. | 从①处通入SO3,整个吸收操作采取逆流的形式 | |
| B. | 从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积 | |
| C. | 从③处导出的气体只含有少量SO2,可直接排入大气 | |
| D. | 从④处流出的是可用水或稀硫酸稀释的浓硫酸 |