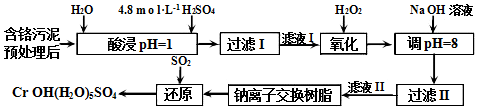
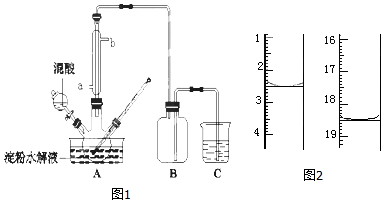
题目内容
5.我国科研人员以Zn和尖晶石型锰酸锌(ZnMn2O4)为电极材料,研制出一种水系锌离子电池.该电池的总反应方程式:xZn+Zn1-xMn2O4$?_{放电}^{充电}$ZnMn2O4(0<x<1).下列说法正确的是( )| A. | 充电时,Zn2+向ZnMn2O4电极迁移 | |
| B. | 充电时,阳极反应:ZnMn2O4-2xe-═Zn1-xMn2O4+xZn2+ | |
| C. | 放电时,每转移1mol e-,ZnMn2O4电极质量增加65g | |
| D. | 充放电过程中,只有Zn元素的化合价发生变化 |
分析 根据电池的电池反应式为:xZn+Zn1-xMn2O4$?_{放电}^{充电}$ZnMn2O4(0<x<1),可知,放电时,Zn的化合价升高,被氧化,为原电池的负极,负极的电极反应式:Zn-2e-=Zn2+;正极反应为:Zn1-xMn2O4+xZn2++2xe-═ZnMn2O4,充电时阴阳极反应与负极、正极反应刚好相反,充电时,电解池阳离子向阴极移动,据此分析解答.
解答 解:A、充电时,阳离子向阴极移动,而可充可放电池中,阴极是原电池的负极,所以Zn2+向锌迁移,故A错误;
B、充电时阳极发生氧化反应,与正极反应刚好相反,所以阳极的电极反应为:ZnMn2O4-2xe-═Zn1-xMn2O4+xZn2+,故B正确;
C、放电时,正极反应为:Zn1-xMn2O4+xZn2++2xe-═ZnMn2O4,所以每转移1mol e-,ZnMn2O4电极质量增加0.5mol×65g/mol=32.5g,故C错误;
D、充放电过程中锰元素的化合价也变化,所以充放电过程中锌与锰的化合价变化,故D错误;
故选B.
点评 本题考查了原电池和电解池原理,根据元素化合价变化确定各个电极上发生的反应,难点是电极反应式的书写,题目难度中等

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.已知下列化合物:①硝基苯 ②环己烷 ③乙苯 ④溴苯 ⑤间二硝基苯.其中能由苯通过一步反应直接制取的是( )
| A. | ①②③ | B. | ①③⑤ | C. | ①②④ | D. | 全部 |
16.现有部分元素的性质、用途与原子(或分子)结构如表所示:
(1)元素Y在周期表中的位置第二周期ⅡA族,元素T的简单离子结构示意图 .
.
(2)W、X、Z、T中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式 .
.
(3)元素W与元素X、T可以分别形成多种核外电子总数为10的微粒,其中有四种微粒可以发生反应:甲+乙 $\frac{\underline{\;\;△\;\;}}{\;}$ 丙+丁,该反应为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(4)元素X与元素W以原子个数比1:2化合形成常用于火箭燃料的化合物戊,元素T和元素W以原子个数比为1:1化合形成化合物己,戊与己能发生氧化还原反应,生成X单质和另一种液体化合物,写出该反应的化学方程式N2H4+2H2O2=N2↑+4H2O.
| 元素编号 | 元素性质与原子(或分子)结构 |
| W | 周期表中原子半径最小的元素 |
| X | 氢化物可与其最高价氧化物的水化物反应生成盐 |
| Y | 一种核素在考古时常用来鉴定一些文物的年代 |
| Z | M层比K层少1个电子 |
| T | 存在两种同素异形体,其中一种可吸收紫外线 |
 .
.(2)W、X、Z、T中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式
 .
.(3)元素W与元素X、T可以分别形成多种核外电子总数为10的微粒,其中有四种微粒可以发生反应:甲+乙 $\frac{\underline{\;\;△\;\;}}{\;}$ 丙+丁,该反应为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(4)元素X与元素W以原子个数比1:2化合形成常用于火箭燃料的化合物戊,元素T和元素W以原子个数比为1:1化合形成化合物己,戊与己能发生氧化还原反应,生成X单质和另一种液体化合物,写出该反应的化学方程式N2H4+2H2O2=N2↑+4H2O.
13.化合物X是一种医药中间体,其结构简式如图所示.下列有关X的说法正确的是( )


| A. | 分子中含2个手性碳原子 | |
| B. | 分子中所有碳原子均处于同一平面 | |
| C. | 能发生银镜反应,不能发生酯化反应 | |
| D. | 1molX最多能与4molH2发生加成反应 |
10.已知常温下0.1mol/L NaHSO3溶液pH<7,将10mL 0.1mol/LBa(OH)2溶液缓慢滴加到10mL 0.1mol/L NaHSO3溶液中,下列说法不正确的是( )
| A. | 常温下0.1 mol/L NaHSO3溶液中HSO3-电离程度大于水解程度 | |
| B. | 当加入的Ba(OH)2溶液体积小于5 mL时,溶液中的反应为:2HSO3-+Ba2++2OH-?BaSO3↓+2H2O+SO32- | |
| C. | 滴加过程中,溶液中白色沉淀不断增加 | |
| D. | 当加入Ba(OH)2溶液体积为7.5 mL时,溶液中离子浓度大小为:c(Na+)>c(SO32-)>c(OH-)>c(H+) |
17. 已知:苯酚(
已知:苯酚(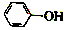 )在水中的电离方程式为
)在水中的电离方程式为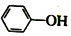 ?
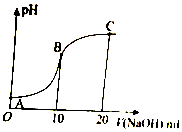
?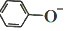 +H+,25℃时,苯酚的电离常数Ka=1.0×10-10.25℃时,用0.0100mol•L-1的NaOH溶液滴定20.00mL0.0100mol•L-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示.下列说法正确的是( )
+H+,25℃时,苯酚的电离常数Ka=1.0×10-10.25℃时,用0.0100mol•L-1的NaOH溶液滴定20.00mL0.0100mol•L-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示.下列说法正确的是( )
 已知:苯酚(
已知:苯酚( )在水中的电离方程式为
)在水中的电离方程式为 ?
? +H+,25℃时,苯酚的电离常数Ka=1.0×10-10.25℃时,用0.0100mol•L-1的NaOH溶液滴定20.00mL0.0100mol•L-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示.下列说法正确的是( )
+H+,25℃时,苯酚的电离常数Ka=1.0×10-10.25℃时,用0.0100mol•L-1的NaOH溶液滴定20.00mL0.0100mol•L-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示.下列说法正确的是( )| A. | A点溶液中,苯酚的电离度约为0.01% | |
| B. | B点溶液的pH<7 | |
| C. | C点溶液中存在c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) | |
| D. | A 点溶液加少量水稀释,溶液中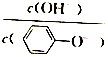 减小 减小 |
14.下列有关同位素的说法正确的是( )
| A. | 18O的中子数为8 | B. | 16O和18O质子数相差2 | ||
| C. | 16O与18O核电荷数相等 | D. | 1个16O与1个18O质量相等 |