题目内容
表是元素周期表的一部分,所列字母分别代表一种元素:
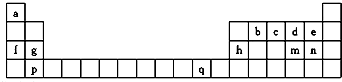
(1)q元素位于周期表中 区.
(2)下列有关说法正确的是 (填字母).
A.b、c、d元素的电负性逐渐增大
B.f、g、h元素的第一电离能逐渐增大
C.md2与bd2的化学性质类似,都是极性分子
D.f、g分别与e组成的物质的晶格能,前者比后者低
E.a、b和d以原子个数比2:1:1构成的最简单化合物分子中σ键和π键的个数比为3:1
F.ae熔沸点高于an,是因为ae分子内共价键键能大于an
(3)mdn2是一种很重要的化学试剂,可以作为氯化剂和脱水剂.该分子的几何构型是 ;中心原子采取 杂化方式.
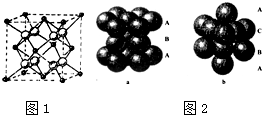
(4)pe2晶胞如图1所示,该晶体中e-离子的配位数为 ;该晶体中p2+所采用堆积方式如图2中的 (填“a”或“b”).

(1)q元素位于周期表中
(2)下列有关说法正确的是
A.b、c、d元素的电负性逐渐增大
B.f、g、h元素的第一电离能逐渐增大
C.md2与bd2的化学性质类似,都是极性分子
D.f、g分别与e组成的物质的晶格能,前者比后者低
E.a、b和d以原子个数比2:1:1构成的最简单化合物分子中σ键和π键的个数比为3:1
F.ae熔沸点高于an,是因为ae分子内共价键键能大于an
(3)mdn2是一种很重要的化学试剂,可以作为氯化剂和脱水剂.该分子的几何构型是
(4)pe2晶胞如图1所示,该晶体中e-离子的配位数为

考点:元素周期律和元素周期表的综合应用,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:
分析:由元素在周期表中位置可知,a为H、b为C、c为N,d为O、e为F、f为Na、g为Mg、h为Al、m为S、n为Cl、p为Ca、q为Cu;
(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区;(n-1)d全充满,最后的电子填s轨道,为ds区元素;
(2)A.同周期自左而右,元素的电负性增大;
B.同周期自左而右,第一电离能增大,但g为Mg元素,3s能级为全满稳定状态,能量降低,第一电离能高于同周期相邻元素;
C.CO2与SO2都属于酸性氧化物,化学性质具有一定类似性,CO2是直线对称结构,为非极性分子,对于ABn型分子,A原子的最外层电子全部成键,该分子是非极性分子,据此判断SO2分子极性;
D.离子键强越强,晶格能越高,MgF2中Mg2+的电荷比Na+的多、半径都比NaF中Na+的半径小,故MgF2中离子键更强;
E.a、b和d以原子个数比2:1:1构成的最简单化合物为CH2O,σ键和π键的个数比为3:1;
F.HF熔沸点高于HCl,是因为HF分子存在氢键;
(3)mdn2是SOCl2,中心原子S原子的最外层电子全部成键,空间结构为三角锥形,采用sp3 杂化;
(4)由CaF2晶胞利用均摊计算原子数目,判断晶胞中哪种球代表F-离子,根据晶胞观察F-离子的配位数,根据CaF2晶胞结构判断Ca2+所采用堆积方式;
(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区;(n-1)d全充满,最后的电子填s轨道,为ds区元素;
(2)A.同周期自左而右,元素的电负性增大;
B.同周期自左而右,第一电离能增大,但g为Mg元素,3s能级为全满稳定状态,能量降低,第一电离能高于同周期相邻元素;
C.CO2与SO2都属于酸性氧化物,化学性质具有一定类似性,CO2是直线对称结构,为非极性分子,对于ABn型分子,A原子的最外层电子全部成键,该分子是非极性分子,据此判断SO2分子极性;
D.离子键强越强,晶格能越高,MgF2中Mg2+的电荷比Na+的多、半径都比NaF中Na+的半径小,故MgF2中离子键更强;
E.a、b和d以原子个数比2:1:1构成的最简单化合物为CH2O,σ键和π键的个数比为3:1;
F.HF熔沸点高于HCl,是因为HF分子存在氢键;
(3)mdn2是SOCl2,中心原子S原子的最外层电子全部成键,空间结构为三角锥形,采用sp3 杂化;
(4)由CaF2晶胞利用均摊计算原子数目,判断晶胞中哪种球代表F-离子,根据晶胞观察F-离子的配位数,根据CaF2晶胞结构判断Ca2+所采用堆积方式;
解答:
解:由元素在周期表中位置可知,a为H、b为C、c为N,d为O、e为F、f为Na、g为Mg、h为Al、m为S、n为Cl、p为Ca、q为Cu;
(1)最后填充s电子,为s区元素,包括ⅠA、ⅡA及He元素,最后填充p轨道电子,为p区元素,主要为主族和0族元素,最后填充d轨道电子,为d区元素,包括ⅢB~ⅤⅡB和ⅤⅢ族(锕系、镧系除外),为过渡元素,(n-1)d全充满,最后的电子填在s轨道上,为ds区元素,包括ⅠB、ⅡB元素,为过渡金属,(n-1)d10ns2电子构型的元素,(n-1)d全充满,最后2个电子填在s轨道上,为ds区元素,q为Cu,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,(n-1)d全充满,最后1个电子填在s轨道上,为ds区元素,
故答案为:ds;
(2)A.同周期自左而右,元素的电负性增大,故b、c、d元素的电负性逐渐增大,故A正确;
B.同周期自左而右,第一电离能增大,但g为Mg元素,3s能级为全满稳定状态,能量降低,第一电离能高于同周期相邻元素,故大于电离能Mg>Al>Na,故B错误;
C.CO2与SO2都属于酸性氧化物,化学性质具有一定类似性,CO2是直线对称结构,是非极性分子,SO2分子中S元素化合价为+4,S原子最外层6个电子未全部成键,SO2为极性分子,故C错误;
D.离子键强越强,晶格能越高,MgF2中Mg2+的电荷比Na+的多、半径都比NaF中Na+的半径小,故MgF2中离子键更强,晶格能更大,故D正确;
E.a、b和d以原子个数比2:1:1构成的最简单化合物为CH2O,该分子中含有1个C=O双键,2个C-H,单键为σ键,双键中有1个σ键、1个π键;
所以该分子中σ键和π键的个数比为3:1,故E正确;
F.HF熔沸点高于HCl,是因为HF分子存在氢键,故F错误;
故选ADE;
(3)mdn2是SOCl2,中心原子S原子的最外层电子有一孤对电子,价层电子对数为4,采用sp3 杂化,空间构型为三角锥形;
故答案为:三角锥形;sp3;
(4)由CaF2晶胞结构可知,黑色球数目为6×
+8×
=4,白色球为8,故白色球是F-离子,由晶胞可知,每个F-离子周围有4个Ca2+离子,故F-离子的配位数为4,由CaF2晶胞结构可知Ca2+所采用堆积方式为面心立方最密堆积,所以选b;
故答案为:4;b;
(1)最后填充s电子,为s区元素,包括ⅠA、ⅡA及He元素,最后填充p轨道电子,为p区元素,主要为主族和0族元素,最后填充d轨道电子,为d区元素,包括ⅢB~ⅤⅡB和ⅤⅢ族(锕系、镧系除外),为过渡元素,(n-1)d全充满,最后的电子填在s轨道上,为ds区元素,包括ⅠB、ⅡB元素,为过渡金属,(n-1)d10ns2电子构型的元素,(n-1)d全充满,最后2个电子填在s轨道上,为ds区元素,q为Cu,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,(n-1)d全充满,最后1个电子填在s轨道上,为ds区元素,
故答案为:ds;
(2)A.同周期自左而右,元素的电负性增大,故b、c、d元素的电负性逐渐增大,故A正确;
B.同周期自左而右,第一电离能增大,但g为Mg元素,3s能级为全满稳定状态,能量降低,第一电离能高于同周期相邻元素,故大于电离能Mg>Al>Na,故B错误;
C.CO2与SO2都属于酸性氧化物,化学性质具有一定类似性,CO2是直线对称结构,是非极性分子,SO2分子中S元素化合价为+4,S原子最外层6个电子未全部成键,SO2为极性分子,故C错误;
D.离子键强越强,晶格能越高,MgF2中Mg2+的电荷比Na+的多、半径都比NaF中Na+的半径小,故MgF2中离子键更强,晶格能更大,故D正确;
E.a、b和d以原子个数比2:1:1构成的最简单化合物为CH2O,该分子中含有1个C=O双键,2个C-H,单键为σ键,双键中有1个σ键、1个π键;
所以该分子中σ键和π键的个数比为3:1,故E正确;
F.HF熔沸点高于HCl,是因为HF分子存在氢键,故F错误;
故选ADE;
(3)mdn2是SOCl2,中心原子S原子的最外层电子有一孤对电子,价层电子对数为4,采用sp3 杂化,空间构型为三角锥形;
故答案为:三角锥形;sp3;
(4)由CaF2晶胞结构可知,黑色球数目为6×
| 1 |
| 2 |
| 1 |
| 8 |
故答案为:4;b;
点评:本题考查元素周期表的结构、核外电子排布规律、元素周期律、分子结构与性质、晶胞等,综合性较大,侧重考查原子的电子排布及区的划分、杂化轨道等,为高频考点,明确元素在周期表中的位置、元素所处主族、成键数是解本题关键,(4)中注意判断离子,题目难度较大.

练习册系列答案
相关题目
某温度下,将0.2molC(S)和0.3mol H2O(g)投入2L的密闭容器中,发生反应C(S)+H2O(g)?CO+H25min达到平衡后,密度增加了0.3g/L.有关下列说法正确的是( )
| A、从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol?L-1?min-1 | ||
B、达平衡时压强变为原来的
| ||
| C、此温度下该反应的平衡常数为0.0125 | ||
| D、若保持温度和体积不变,向平衡体系中再加入0.2 molC(S)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7% |
微量元素对人体的正常代谢和健康起着重要作用.下列元素中不是微量元素的是( )
| A、Fe | B、H | C、I | D、F |
 (1)已知在常温常压下:
(1)已知在常温常压下: ),聚丙烯酸钠单体的结构简式是
),聚丙烯酸钠单体的结构简式是




