题目内容
 (1)已知在常温常压下:
(1)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol;写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01mol?L-1NaOH溶液时,比较溶液中各种离子浓度的大小关系:
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值
③实验4,若900℃时在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v正
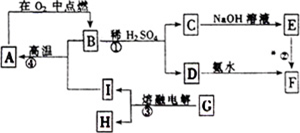
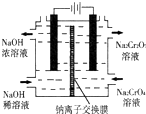
(4)某可采用石墨电极电解Na2CrO4溶液,实现了 Na2CrO4到Na2Cr2O7的转化,其原理如图所示.
①钠离子交换膜的一种材料是聚丙烯酸钠 (
 ),聚丙烯酸钠单体的结构简式是
),聚丙烯酸钠单体的结构简式是②写出阳极的电极反应式
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算,电解原理,离子浓度大小的比较
专题:
分析:(1)根据热化学方程式利用盖斯定律计算反应热并书写热化学方程式;
(2)常温下,向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01mol?L-1NaOH溶液反应得到的溶液中溶质为NaHC2O4,溶液显酸性,据此比较离子浓度大小;
(3)①先求得各物质平衡时的浓度,再根据平衡常数等于生成物浓度系数次幂之积除以反应物浓度系数次幂之积求得平衡常数;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,据此答题;
③根据浓度商Qc与平衡常数K的大小,判断反应进行的方向,进而确定正逆反应的速率;
(4)①依据聚丙烯酸钠是加成聚合反应生成,单体为丙烯酸钠;
②石墨电极电解Na2CrO4溶液,实现了Na2CrO4到Na2Cr2O7的转化,电解池中阳极是溶液中氢氧根离子失电子生成氧气,阴极是CrO42-得到电子生成Cr2O72-;
(2)常温下,向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01mol?L-1NaOH溶液反应得到的溶液中溶质为NaHC2O4,溶液显酸性,据此比较离子浓度大小;
(3)①先求得各物质平衡时的浓度,再根据平衡常数等于生成物浓度系数次幂之积除以反应物浓度系数次幂之积求得平衡常数;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,据此答题;
③根据浓度商Qc与平衡常数K的大小,判断反应进行的方向,进而确定正逆反应的速率;
(4)①依据聚丙烯酸钠是加成聚合反应生成,单体为丙烯酸钠;
②石墨电极电解Na2CrO4溶液,实现了Na2CrO4到Na2Cr2O7的转化,电解池中阳极是溶液中氢氧根离子失电子生成氧气,阴极是CrO42-得到电子生成Cr2O72-;
解答:
解:(1)根据盖斯定律,将已知反应①-②-③×4得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的△H=(-1275.6kJ/mol)-(-566.0kJ/mol)-(-44.0kJ/mol)×4=442.8kJ?mol-1,即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ?mol-1;
(2)常温下,向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01mol?L-1NaOH溶液反应得到的溶液中溶质为NaHC2O4,溶液显酸性,电离大于水解,溶液中离子浓度大小为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),
故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(3)①平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
所以平衡常数K=
=
=0.17,故答案为:0.17;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,所以要使CO的转化率大于水蒸气,则0<
<1,故答案为:0<
<1;
③900℃时,当CO、H2O、CO2、H2均为1mol时,浓度商Qc=
=1>0.17=K,所以此时平衡要逆向移动,故V正<V逆,故答案为:<;
(4)①依据聚丙烯酸钠是加成聚合反应生成,单体为丙烯酸钠,结构简式为CH2=CHCOONa,故答案为:CH2=CHCOONa;
②石墨电极电解Na2CrO4溶液,实现了Na2CrO4到Na2Cr2O7的转化,电解池中阳极是溶液中氢氧根离子失电子生成氧气,阴极是CrO42-得到电子生成Cr2O72-,阳极电极反应为4OH--4e-=2H2O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ?mol-1;
(2)常温下,向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01mol?L-1NaOH溶液反应得到的溶液中溶质为NaHC2O4,溶液显酸性,电离大于水解,溶液中离子浓度大小为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),
故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(3)①平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
所以平衡常数K=
| ||||
|
| 1 |
| 6 |
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,所以要使CO的转化率大于水蒸气,则0<
| a |
| b |
| a |
| b |
③900℃时,当CO、H2O、CO2、H2均为1mol时,浓度商Qc=
| ||||
|
(4)①依据聚丙烯酸钠是加成聚合反应生成,单体为丙烯酸钠,结构简式为CH2=CHCOONa,故答案为:CH2=CHCOONa;
②石墨电极电解Na2CrO4溶液,实现了Na2CrO4到Na2Cr2O7的转化,电解池中阳极是溶液中氢氧根离子失电子生成氧气,阴极是CrO42-得到电子生成Cr2O72-,阳极电极反应为4OH--4e-=2H2O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;
点评:本题主要考查了盖斯定律的应用、溶液离子浓度的比较、化学平衡常数的计算、转化率的应用、平衡常数的应用、电化学知识等知识点,综合性较强,中等难度,解题时注意对基础知识的灵活运用.

练习册系列答案
相关题目
下列有关实验原理或操作的叙述中,正确的是( )
| A、用托盘天平直接称量烧碱4.0g |
| B、在蒸发皿中灼烧CuSO4?5H2O晶体以除去结晶水 |
| C、用标准盐酸溶液滴定未知浓度的氨水,用酚酞作指示剂 |
| D、配制0.9%的氯化钠溶液时,将称量的氯化钠放入烧杯中加计量的水搅拌溶解 |