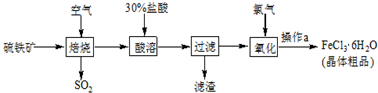
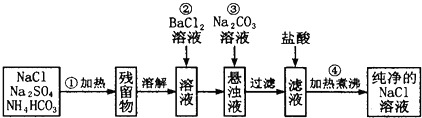
题目内容
某元素的同位素AZX,它的氯化物XCl2 3.33g溶于水制成溶液后,加入1mol/L的AgNO3溶液60mL恰好完全反应.若这种同位素原子核内有20个中子,求:
(1)Z值和A值;
(2)X元素在周期表中的位置;
(3)把X的单质放入酚酞水溶液中,有何现象?写出反应的化学方程式.
(1)Z值和A值;
(2)X元素在周期表中的位置;
(3)把X的单质放入酚酞水溶液中,有何现象?写出反应的化学方程式.
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:根据Cl-+Ag+═AgCl↓计算XCl2的物质的量,再由M=
计算其摩尔质量,摩尔质量与相对分子质量的数值相等,原子的质量数为原子的近似相对原子质量,结合该原子原子核内有20个中子,根据质子数=质量数-中子数来计算原子的质子数,利用质子数确定元素在周期表中的位置,并利用质量守恒定律及X的性质来书写反应方程式,推测现象.
| m |
| M |
解答:
解:(1)由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.06L×1mol/L=0.06mol,
n(XCl2)=
n(Cl-)=
×0.06mol=0.03mol,
则M(XCl2)=
=111g/mol,
所以XCl2相对分子质量为111,
所以X的相对原子质量=111-35.5×2=40,即X的质量数为40,
质子数=质量数-中子数=40-20=20,
答:Z=20,A=40;
(2)X为Ca,位于第四周期第ⅡA族,答:X位于第四周期第ⅡA族;
(3)X的单质放入酚酞水溶液中,发生Ca+2H2O═Ca(OH)2+H2↑,可观察到有气泡产生,酚酞水溶液变红,
答:现象为有气泡产生,酚酞水溶液变红,反应为Ca+2H2O═Ca(OH)2+H2↑.
n(XCl2)=
| 1 |
| 2 |
| 1 |
| 2 |
则M(XCl2)=
| 3.33g |
| 0.03mol |
所以XCl2相对分子质量为111,
所以X的相对原子质量=111-35.5×2=40,即X的质量数为40,
质子数=质量数-中子数=40-20=20,
答:Z=20,A=40;
(2)X为Ca,位于第四周期第ⅡA族,答:X位于第四周期第ⅡA族;
(3)X的单质放入酚酞水溶液中,发生Ca+2H2O═Ca(OH)2+H2↑,可观察到有气泡产生,酚酞水溶液变红,
答:现象为有气泡产生,酚酞水溶液变红,反应为Ca+2H2O═Ca(OH)2+H2↑.
点评:本题考查位置、结构、性质的关系及应用,为高频考点,把握发生的反应、物质的量计算及元素的推断为解答的关键,侧重分析、计算及推断能力的考查,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
下列各组物质中,全都属于纯净物的是( )
| A、液氯和氯水 |
| B、漂白粉和乙醇 |
| C、食盐水和硫酸亚铁 |
| D、干冰和冰水混合物 |
下列说法正确的是( )
| A、HD、CaCl2、NaOH、HCl四种物质都属于化合物 |
| B、有单质参加或生成的反应一定属于氧化还原反应 |
| C、金属氧化物不一定是碱性氧化物,酸酐不一定是酸性氧化物 |
| D、金属单质只能做还原剂,非金属单质只能做氧化剂 |
有KCl、KBr、KI三瓶溶液,由于试剂瓶标签遗失,用下列哪种溶液可以把它们鉴别出来( )
| A、NaOH |
| B、HCl |
| C、AgNO3 |
| D、CuSO4 |
下列说法正确的是( )
| A、葡萄糖能氧化新制氢氧化铜生成红色的氧化亚铜(Cu2O) |
| B、甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应 |
| C、羊毛、蚕丝、棉花和麻等天然高分子材料的主要成分都是蛋白质 |
| D、乙酸和甲酸乙酯互为同分异构体 |
下列溶液中肯定为酸性的是( )
| A、含H+的溶液 |
| B、pH<7的溶液 |
| C、c(OH-)<c(H+)的溶液 |
| D、能和NaOH发生反应的溶液 |