题目内容
下列家庭化学小实验不能达到预期目的是( )
| A、用米汤检验食用加碘盐中含有碘 |
| B、用醋、石灰水验证蛋壳中含有碳酸盐 |
| C、用碘酒检验葡萄中是否含有淀粉 |
| D、用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验 |
考点:淀粉的性质和用途,乙酸的化学性质,蛋白质的盐析
专题:
分析:A.淀粉遇单质碘变蓝;
B.醋酸的酸性比碳酸强,二氧化碳与石灰水反应生成碳酸钙沉淀;
C.碘遇淀粉变蓝色;
D.蛋白质难溶于饱和食盐水.
B.醋酸的酸性比碳酸强,二氧化碳与石灰水反应生成碳酸钙沉淀;
C.碘遇淀粉变蓝色;
D.蛋白质难溶于饱和食盐水.
解答:
解:A.淀粉遇单质碘变蓝,而食用加碘盐为KIO3,不能用来检验,故A错误;
B.醋酸的酸性比碳酸强,与碳酸盐反应生成二氧化碳气体,二氧化碳与石灰水反应生成碳酸钙沉淀而使溶液变浑浊,故可用用醋、石灰水验证蛋壳中含有碳酸盐,故B正确;
C.碘遇淀粉变蓝色,可检验淀粉,故C正确;
D.蛋白质难溶于饱和食盐水,属于盐析现象,为可逆过程,加水后能重新溶解,故D正确.
故选A.
B.醋酸的酸性比碳酸强,与碳酸盐反应生成二氧化碳气体,二氧化碳与石灰水反应生成碳酸钙沉淀而使溶液变浑浊,故可用用醋、石灰水验证蛋壳中含有碳酸盐,故B正确;
C.碘遇淀粉变蓝色,可检验淀粉,故C正确;
D.蛋白质难溶于饱和食盐水,属于盐析现象,为可逆过程,加水后能重新溶解,故D正确.
故选A.
点评:本题考查物质的检验和鉴别,题目难度不大,本题注意碘盐的组成、注意蛋白质的性质.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
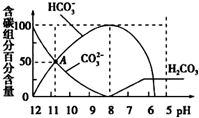 常温下,在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L 盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.下列说法不正确的是( )
常温下,在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L 盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.下列说法不正确的是( )| A、0.1 mol/L Na2CO3溶液中c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
| B、在A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C、常温下CO2饱和溶液的pH约为5.6 |
| D、当加入20 mL盐酸时,混合溶液的pH约为8 |
下列各反应均为放热反应,同温同压下下列各热化学方程式中△H最小的是( )
| A、2A(l)+B (l)═2C(g)△H1 |
| B、2A(g)+B (g)═2C(g)△H2 |
| C、2A(g)+B ( g )═2C(l)△H3 |
| D、2A(l)+B (l)═2C(l)△H4 |
分子式为C5H12O并能与金属钠反应放出氢气的有机化合物有( )
| A、6种 | B、7种 | C、8种 | D、9种 |
分子式为C5H12O的醇与和它相对分子质量相等的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)( )
| A、15种 | B、16种 |
| C、17种 | D、18种 |
设 NA为阿伏加德罗常数,下列有关叙述正确的是( )
| A、78g过氧化钠晶体中,含NA个阴离子 |
| B、56gFe 与稀 H N03 完全反应时一定转移3NA个电子 |
| C、常温常压下,22.4L氦气含有NA个氦原子 |
| D、已知热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol (Q>0),则将 2NA 个SO2分子和 NA 个O2分子置于一密闭容器中充分反应后放出QkJ的热量 |



