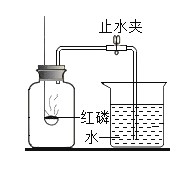
【题目】实验是科学探究的重要方法。如图是测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题。已知:铜+氧气→氧化铜(黑色固体)

(1) 根据下表提供的实验数据,完成下表
硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
25mL | 15mL | 9mL | _________________。 |
(2)装置一和装置二中气球的位置不同,_________________装置 (填“一”或“二”)更合理。
【题目】制作糕点常用Na2CO3或NaHCO3做膨松剂,同学们根据Na2CO3和NaHCO3的性质进行了一系列探究。
(1)NaHCO3和Na2CO3性质差异的探究
[查阅资料]
物质 | Na2CO3 | NaHCO3 | |||||
酸碱性 | 水溶液显碱性 | 水溶液显弱碱性 | |||||
热稳定性 | 受热不分解 | 270℃时完全分解 | |||||
溶解度 | 10℃ | 20℃ | 30℃ | 40℃ | |||
Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g | |||
NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g | |||
(实验探究)
①验证水溶液的酸碱性的差异:分别测两种物质溶液的pH值,请写出测定pH值的方法____________,测定结果:NaHCO3的pH值___________Na2CO3(填“>”或”“<”)。
②验证两种粉末的稳定性:观察到装置中__________(填“甲”或“乙”)烧杯中澄清石灰水变浑浊,该烧杯中发生的反应方程式为_______________。

③利用溶解度的差异鉴别NaHCO3和Na2CO3:小方同学分别取Xg两种固体粉末加入20℃,10g水中充分溶解,通过观察现象区分出碳酸钠和碳酸氢钠,X可以是下列的___________。
A2g B0.96g C0.5g D3g
(2)测定某NaHCO3和Na2CO3混合物中NaHCO3的质量分数利用如图装置进行实验,装置B中放有10g该样品(整套装置气密性良好,各装置中气体吸收剂足量)。

①实验前测定装置D的质量为122.2g,上图装置C的作用是_______________,装置E的作用是_____________,若没有装置E,造成测定结果____________(填“偏大”、“不变”或“偏小”)。
②实验过程中必须向装置内通入空气,装置A中发生的化学反应方程式______________,若没有装置A,造成测定结果_______(填“偏大”、“不变”或“偏小”)。在加热前,先对装置A、B和C(已连接)通一段时间的空气,再连接上装置D、E,目的是_______________;在停止加热后,仍继续通入空气一段时间,目的是____________________。
【题目】在研究酸和碱的化学性质时,某小组想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。请与他们一起完成实验方案设计、实施和评价。
(1)探究稀H2SO4与NaOH溶液的反应。
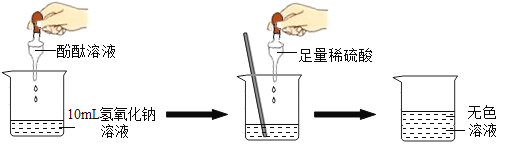
当滴入几滴酚酞溶液后,溶液由无色变为______色。根据上述实验中颜色变化,确定稀H2SO4与NaOH溶液发生了化学反应。反应的化学方程式为______。
(2)探究上述稀H2SO4与NaOH溶液反应后烧杯中的硫酸是否过量。
①根据上述反应过程中溶液变成无色,不能确定稀H2SO4是否过量,同学们又分别选取BaCl2、紫色石蕊溶液设计实验方案,请你判断并
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的BaCl2溶液 | 出现白色沉淀 | 稀H2SO4过量 |
方案二 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 稀H2SO4过量 |
上述设计的实验方案中,正确的是__________(选填:方案一、方案二)。另外一个实验方案错误的原因是:____________。
②你认为下列药品或方法也能确定稀H2SO4过量的有__________(填字母代号)。
A加入碳酸钠 B加入锌粒 C加入氢氧化镁 D测定溶液pH