题目内容
【题目】制作糕点常用Na2CO3或NaHCO3做膨松剂,同学们根据Na2CO3和NaHCO3的性质进行了一系列探究。
(1)NaHCO3和Na2CO3性质差异的探究
[查阅资料]
物质 | Na2CO3 | NaHCO3 | |||||
酸碱性 | 水溶液显碱性 | 水溶液显弱碱性 | |||||
热稳定性 | 受热不分解 | 270℃时完全分解 | |||||
溶解度 | 10℃ | 20℃ | 30℃ | 40℃ | |||
Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g | |||
NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g | |||
(实验探究)
①验证水溶液的酸碱性的差异:分别测两种物质溶液的pH值,请写出测定pH值的方法____________,测定结果:NaHCO3的pH值___________Na2CO3(填“>”或”“<”)。
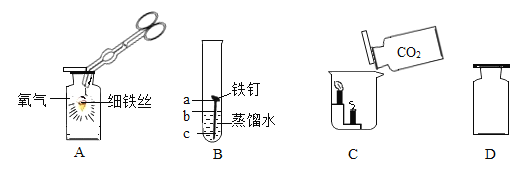
②验证两种粉末的稳定性:观察到装置中__________(填“甲”或“乙”)烧杯中澄清石灰水变浑浊,该烧杯中发生的反应方程式为_______________。

③利用溶解度的差异鉴别NaHCO3和Na2CO3:小方同学分别取Xg两种固体粉末加入20℃,10g水中充分溶解,通过观察现象区分出碳酸钠和碳酸氢钠,X可以是下列的___________。
A2g B0.96g C0.5g D3g
(2)测定某NaHCO3和Na2CO3混合物中NaHCO3的质量分数利用如图装置进行实验,装置B中放有10g该样品(整套装置气密性良好,各装置中气体吸收剂足量)。
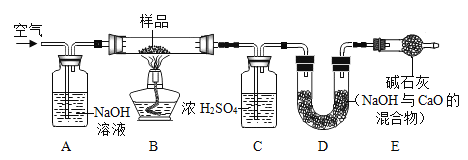
①实验前测定装置D的质量为122.2g,上图装置C的作用是_______________,装置E的作用是_____________,若没有装置E,造成测定结果____________(填“偏大”、“不变”或“偏小”)。
②实验过程中必须向装置内通入空气,装置A中发生的化学反应方程式______________,若没有装置A,造成测定结果_______(填“偏大”、“不变”或“偏小”)。在加热前,先对装置A、B和C(已连接)通一段时间的空气,再连接上装置D、E,目的是_______________;在停止加热后,仍继续通入空气一段时间,目的是____________________。
【答案】用玻璃棒蘸取待测液在pH试纸上,然后与标准比色卡对照 < 乙 Ca(OH)2+CO2=CaCO3 +H2O A 吸收气体中的水蒸气 防止空气中水和二氧化碳进入D中产生干扰 偏大 2NaOH+CO2=Na2CO3+H2O 偏大 排出装置中有CO2的空气 将装置中产生的二氧化碳全部压入D中被完全吸收
【解析】
[实验探究]
①用玻璃棒蘸取待测液在pH试纸上,然后与标准比色卡对照,从而确定溶液的pH;溶液的碱性越强,pH越大;故填:用玻璃棒蘸取待测液在pH试纸上,然后与标准比色卡对照,读出pH;<;
②由图表关于两者的热稳定性进行分析可知:碳酸氢钠可以加热分解生成二氧化碳,而碳酸钠不能,所以分析装置可知乙烧杯的澄清石灰水变浑浊,该烧杯中发生的反应方程式为Ca(OH)2+CO2=CaCO3 +H2O。故填:乙;Ca(OH)2+CO2=CaCO3 +H2O;
③20℃时碳酸钠和碳酸氢钠的溶解度分别为21.5g和9.6g,那么在该温度下,10g水中最多溶解2.15g碳酸钠达到饱和,最多溶解0.96g碳酸氢钠达到饱和,因此可分别加入2g固体,充分搅拌后,若完全溶解则为碳酸钠,若不能完全溶解则为碳酸氢钠;故填:A;
(2)①实验前测定装置D的质量为122.2g,上图装置C的作用是吸收气体中的水蒸气,装置E的作用是防止空气中水和二氧化碳进入D中产生干扰,如果没有E装置,空气中二氧化碳会进入D装置,造成二氧化碳增多,结果偏大。故填:吸收气体中的水蒸气;防止空气中水和二氧化碳进入D中产生干扰;偏大;
②因为二氧化碳能与氢氧化钠反应生成碳酸钠和水,所以装置A中发生的化学反应方程式为:2NaOH+CO2=Na2CO3+H2O;由于反应前装置内的空气中含有二氧化碳,会使得测定结果偏大;在加热前,先对装置A、B和C(已连接)通一段时间的空气,再连接上装置D、E,目的是除去装置内空气中的二氧化碳,防止影响实验结果;在停止加热后,仍继续通入空气一段时间,目的是将装置B中二氧化碳全部赶入装置D中,否则实验结果会偏小;故填:2NaOH+CO2=Na2CO3+H2O;偏大;排出装置中有CO2的空气;将装置中产生的二氧化碳全部压入D中被完全吸收。

【题目】下表中所描述的变化与右图相符合的是
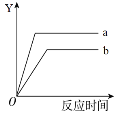
化学变化 | Y轴 | a | b | |
A | 等质量的高锰酸钾和水在不同条件下分解 | 氧气质量 | 高锰酸钾 | 水 |
B | 等质量、等浓度的双氧水在不同条件下反应 | 氧气质量 | 加催化剂 | 加热 |
C | 等质量的镁片和铁片分别与足量的稀硫酸反应 | 氢气质量 | 镁 | 铁 |
D | 等质量的二氧化碳和生石灰分别与等量的水反应 | 温度 | 二氧化碳 | 生石灰 |