题目内容
【题目】在研究酸和碱的化学性质时,某小组想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。请与他们一起完成实验方案设计、实施和评价。
(1)探究稀H2SO4与NaOH溶液的反应。
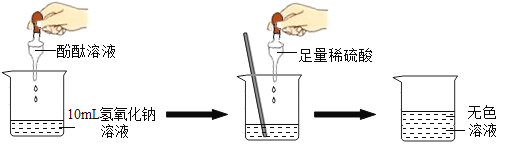
当滴入几滴酚酞溶液后,溶液由无色变为______色。根据上述实验中颜色变化,确定稀H2SO4与NaOH溶液发生了化学反应。反应的化学方程式为______。
(2)探究上述稀H2SO4与NaOH溶液反应后烧杯中的硫酸是否过量。
①根据上述反应过程中溶液变成无色,不能确定稀H2SO4是否过量,同学们又分别选取BaCl2、紫色石蕊溶液设计实验方案,请你判断并
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的BaCl2溶液 | 出现白色沉淀 | 稀H2SO4过量 |
方案二 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 稀H2SO4过量 |
上述设计的实验方案中,正确的是__________(选填:方案一、方案二)。另外一个实验方案错误的原因是:____________。
②你认为下列药品或方法也能确定稀H2SO4过量的有__________(填字母代号)。
A加入碳酸钠 B加入锌粒 C加入氢氧化镁 D测定溶液pH
【答案】红色 2NaOH+H2SO4=Na2SO4 +2H2O 方案二 方案一错误的原因是溶液中有生成的硫酸钠,加入氯化钡溶液同样产生白色沉淀 ABCD
【解析】
(1)酚酞遇碱变红色,氢氧化钠与稀硫酸反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O,故答案为:红色;2NaOH+H2SO4=Na2SO4+2H2O
(2)①因为方案一即使硫酸不过量,生成的硫酸钠也与氯化钡反应生成硫酸钡沉淀,而石蕊试液遇酸变红色,所以方案二正确;故填:方案二;方案一错误的原因是溶液中有生成的硫酸钠,加入氯化钡溶液同样产生白色沉淀;
②A、碳酸钠能与酸反应生成二氧化碳气体,如果有气泡产生,说明酸过量,正确;
B、因为活泼金属与酸反应生成氢气,所以可以加入锌粒等活泼金属,正确;
C、氢氧化镁固体能与酸反应而溶解,如果氢氧化镁固体溶解,证明酸过量,正确;
D、硫酸显酸性,能通过测定溶液pH证明硫酸是否过量,正确。
故选:ABCD。