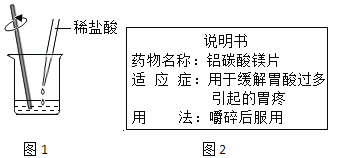
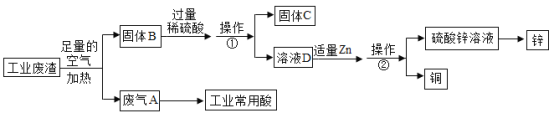
0 207682 207690 207696 207700 207706 207708 207712 207718 207720 207726 207732 207736 207738 207742 207748 207750 207756 207760 207762 207766 207768 207772 207774 207776 207777 207778 207780 207781 207782 207784 207786 207790 207792 207796 207798 207802 207808 207810 207816 207820 207822 207826 207832 207838 207840 207846 207850 207852 207858 207862 207868 207876 211419