题目内容
【题目】二甲醚(C2H6O)以其无污染、易于制造的特征,可能成为一种全新的替代能源而普及。 有关二甲醚的叙述正确的是
A.二甲醚由 9 个原子构成
B.2.3 g 二甲醚中含碳元素的质量为 1.2 g
C.二甲醚中碳、氢、氧三种元素的质量比为 2︰6︰1
D.二甲醚和甲烷在氧气中完全燃烧的产物不相同
【答案】B
【解析】
A、二甲醚由二甲醚分子构成,每个二甲醚分子由2个碳原子、6个氢原子、1个氧原子,共9个原子构成,不符合题意;
B、2.3 g 二甲醚中含碳元素的质量为: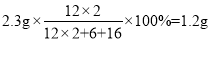 ,符合题意;
,符合题意;
C、二甲醚中碳、氢、氧三种元素的质量比为:(12×2):6:16=12:3:8,不符合题意;
D、二甲醚和甲烷在氧气中完全燃烧的产物相同,燃烧后的产物都是二氧化碳和水,不符合题意。
故选B。

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
【题目】下列对某一主题的知识归纳,全部正确的一组是
A.水资源 | B.化学与健康 |
废水——生活污水直接排放 硬水和软水——可用肥皂水来检验 | 人体缺乏维生素B——引起坏血病 铁、锌、钙元素——都是人体必须的微量元素 |
C.微观粒子 | D. 食品安全 |
春天处处闻花香——分子在不停运动 硫离子结构示意图为: | 工业酒精——含有甲醇等有毒物质,不能饮用 黄曲霉素(C17H12O6)——属于有机物,食用霉变后含有黄曲霉素的食物可能诱发癌变 |
A. A B. B C. C D. D