��Ŀ����
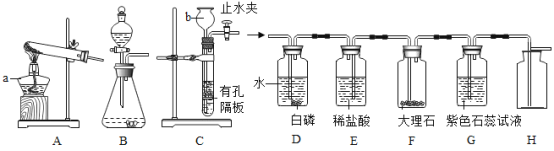
����Ŀ���ڢ֣��û�ѧ��������ȡ���������ʣ���ѧ��ȤС��Ӧ���кͷ�Ӧԭ����ȡ�Ȼ��ƹ��塣
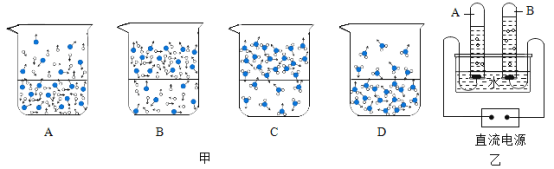
��1����װ������������Һ���ձ��е�����ɫʯ����Һ����Һ��_____ɫ��
��2����ͼ1�������ձ��м�����εμ�ϡ��������Һǡ�ñ�Ϊ��ɫ��������Ӧ�����Һ�м������̿����ֻ�ϣ����˺�õ���ɫ��Һ��
�ټ������̿��Ŀ����_____��
���ڹ��˲����У���������������_____��
��3����pH��ֽ�⣨2������Һ�����ȣ������������ȡpH��ֽ�ڲ���Ƭ�ϣ�_____������ֽ��ʾ����ɫ�����ɫ���Ƚϣ�������Һ��pH��
��4���������ҺpHΪ8����������Һ�μ��Թ��������ᣬĿ����_____����������Һ�Գ�ȥ���������ᣬ�ò������õ������������_____������������Һ�õ�����Ĺ����У��ò��������Ͻ����Ŀ����_____��
�ڢ֣�θ���������ÿ���ҩ��������ᷴӦ������ͼ2Ϊ��̼��þ˵����IJ������ݡ���ȤС��Ը�ҩ�↑չ����̽����
��1����ҩ������õ�̽��
���ϱ�������̼��þ[����Ҫ�ɷֵĻ�ѧʽΪAlMg(OH)3CO3]�����ᷴӦ�Ļ�ѧ����ʽΪ��AlMg(OH)3CO3+5HCl=MgCl2+AlCl3+4H2O+CO2��
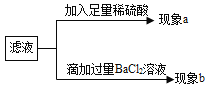
�ٽ���Ӧ����������ͨ�����ʯ��ˮ�����۲쵽��������_____���÷�Ӧ�Ļ�ѧ����ʽΪ_____��
�ڸ������к���Al3+��Mg2+��OH����![]() ����ϸ����������ᷴӦ�Ļ�ѧ����ʽ��������ҩ���������ã�����θҺ���ԣ�������_____��_____���������ţ���
����ϸ����������ᷴӦ�Ļ�ѧ����ʽ��������ҩ���������ã�����θҺ���ԣ�������_____��_____���������ţ���
��2�����÷�����̽��
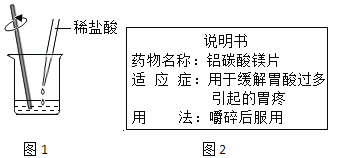
�ÿ���ҩΪʲôҪ����������������С������������������ͬ������ҩƬ���������ã������ĸ����θ������С������Ϊ�������ҩ�ォ��θҺ�е����ᷴӦ������
����Ȼ��С������Ǵ���ġ�ԭ����_____��
��С�����������ʵ����֤���Լ��IJ��룺
��ʵ��1����һƬ������ҩƬ�����Թ��У������м���5mL5%��ϡ���
��ʵ��2����һƬ������ҩƬ���������Թ��У������м���5mL5%��ϡ���ᡣ
�Ա�ʵ��1��ʵ��2��С���۲쵽������Ϊ_____��֤�������IJ�����ȷ��
��3����Ҫ�ɷֺ�����̽������ȤС��ȡ6ƬҩƬ���������Թ��У��������������ϡ���ᣬ��ַ�Ӧ��ų�����0.88g����ͨ�����㣬ÿƬҩ���к���AlMg(OH)3CO3�������Ƕ��٣�____�����������0.1������֪��ҩ�����������ɷֲ���ϡ���ᷴӦ��AlMg(OH)3CO3����Է�������Ϊ162��
���𰸡��� ������ɫ���� ���� ���ò�����պȡ��Һ��ճ��pH��ֽ�� ��ȥ�������������� �ӷ� ��ֹҺ�����Ȳ�������Һ�ηɽ� ����ʯ��ˮ����� Ca(OH)2+CO2=CaCO3��+H2O OH�� ![]() ��ͬ������ҩƬ���ĵ�θ��������� ʵ��2�в������ݵ����ʱ�ʵ��1�еĿ� 0.5g
��ͬ������ҩƬ���ĵ�θ��������� ʵ��2�в������ݵ����ʱ�ʵ��1�еĿ� 0.5g
��������
�ڢ֣�
��1������������Һ�ʼ��ԣ���ɫʯ����Һ���������
��2���ٻ���̿�����������ã���������ɫ���ʣ����ڹ��˲����У���������������������
��3����pH��ֽ�⣨2������Һ�����ȣ������������ȡpH��ֽ�ڲ���Ƭ�ϣ����ò�����պȡ��Һ��ճ��pH��ֽ�ϣ�����ֽ��ʾ����ɫ�����ɫ���Ƚϣ�������Һ��pH��
��4���������ҺpHΪ8��˵����Һ�ʼ��ԣ���������Һ�μ��Թ��������ᣬĿ���dz�ȥ�������������ƣ���������Һ���Գ�ȥ���������ᣬ����Ϊ��������ӷ������ʣ�����������Һ�õ�����Ĺ����У�Ӧ�ò��������Ͻ��裬��ֹҺ�����Ȳ�������Һ�ηɽ���
�ڢ֣���1���ٸ÷�Ӧ����������Ϊ������̼����ʹ����ʯ��ˮ����ǣ�������Ϊ�������ƺͶ�����̼��Ӧ������̼��Ƴ�����ˮ���÷�Ӧ�Ļ�ѧ����ʽΪ��Ca(OH)2+CO2=CaCO3��+H2O��
�ڸ������к���Al3+��Mg2+��OH����![]() ������OH����
������OH����![]() ����H+��Ӧ�������������ܺ�ϡ�����е������ӽ�ϳ�ˮ��̼��������ܺ�ϡ�����е������ӽ������ˮ�Ͷ�����̼��
����H+��Ӧ�������������ܺ�ϡ�����е������ӽ�ϳ�ˮ��̼��������ܺ�ϡ�����е������ӽ������ˮ�Ͷ�����̼��
��2��ҩ�����ǰ����������ı䣬��ͬ������ҩƬ���ĵ�θ��������ȡ�
����ʵ��2�в������ݵ����ʱ�ʵ��1�еĿ죬��֤���������ҩ�ォ��θҺ�е����ᷴӦ������
��3����ÿƬҩ���к���AlMg(OH)3CO3������Ϊx��
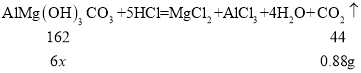
![]()
x=0.54g![]() 0.5g��
0.5g��
��ÿƬҩ���к���AlMg(OH)3CO3��������0.5g��