【题目】科学方法对化学学习起着事半功倍的作用。
(1)分类归纳是研究化学物质的重要方法。如图是某同学整理的碳及其化合物的知识网络图,转化③常用于冶炼工业,工业上用赤铁矿炼铁时,反应的化学方程式为_____,二氧化碳使紫色石蕊试液变红涉及的反应是如图所示转化中_____(填序号)。

(2)微观粒子模型化是研究化学变化的重要方法。
①如图是钠与氯气反应生成氯化钠的示意图。该图说明在化学反应过程中一定发生变化的是_____(填字母)。
A 原子核 B 原子核最外层电子数 C 原子的电子层数
②如图是硫酸铜溶液与氯化钡溶液反应示意图。从粒子角度分析该化学反应能发生的原因是_____。

③A、B、C、D表示4种物质,如图是部分物质的微观示意图。A和B在一定条件下反应生成C和D.
物质 | B | C | D |
|
微观示意图 |
|
|
|
一定质量的A和4.8g B恰好完全反应,可生成4.4gC和2.7gD,则A的化学式是_____。
④我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破。甲烷转化反应的微观示意图如图:
图示所表示的反应的化学方程式为_____。
(3)控制变量、设计对比实验是实验探究的重要方法。

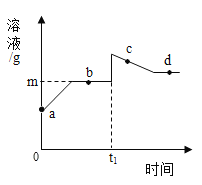
如图实验是大小形状相同的Mg、Zn、Fe、Cu四种金属同时投入到盐酸中发生的现象,金属周围的黑点表示生成的气体。下列结论不正确的是_____(填字母)。
A 铜不能发生置换反应
B 四种金属中金属活动性最强的是Mg
C 等质量的锌和铁分别与足量的盐酸反应生成气体质量:Zn比Fe多
【题目】“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺,同学们查阅相关资料并进行模拟实验.
(查阅资料)
①生产原理:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(固体)↓+NH4Cl
②主要生产流程如图所示:
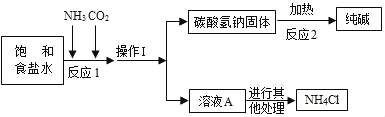
③氨气(NH3)是一种有刺激性气味的气体,极易溶于水,其水溶液显碱性.
(理论分析)
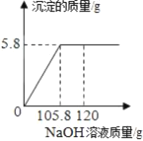
(1)依据资料①可知相同条件下,NaHCO3的溶解度_____NH4Cl的溶解度(填“>”或“<”).
(2)NaHCO3受热分解制得纯碱及两种常见的氧化物,该反应的化学方程式是_____.
(模拟实验)验证侯氏制碱法能获得纯碱
步骤 | 蘸有稀硫酸 实验装置 | 实验操作及现象 | 解释与结论 |
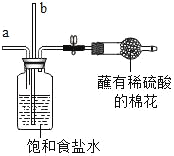
1 |
| 从a管通入NH3,一段时间后,从b管通入CO2,溶液中有固体析出 | (1)蘸有稀硫酸的棉花的作用是_____ (2)通NH3的a管若伸到液面下,会造成的后果是_____ |
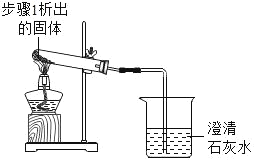
2 |
| 加热,导管口有气泡,澄清石灰水变浑浊 | 步骤1析出的固体是碳酸氢钠 |
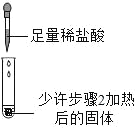
3 |
| 滴加足量稀盐酸,有气泡产生,固体逐渐消失 | 步骤2加热后得到的固体是纯碱 |
(实验反思)同学们认为步骤3的结论存在不足.依据题中信息,设计实验确定步骤2加热后得到的固体成分,其方案是_____.
【题目】甲同学用如图所示装置制得CO2,并验证CO2能与水反应生成酸的性质。

B试管发生的现象是_____,反应方程式是_____。
乙同学在实验时闻到制得的CO2有些刺激性气味,于是乙同学对气味的来源以及能使紫色石蕊溶液变红的酸性物质进行如下探究:
(查阅资料)大理石与稀盐酸反应产生热量;大理石无气味,稀盐酸有刺激性气味。
(提出猜想)刺激性气味来源于稀盐酸,并且混入与:
I.温度有关 II._____ III.温度及气流的速率有关
(进行实验)实验装置如下(三个实验中所用稀盐酸及紫色石蕊溶液的体积、溶质的质量分数均相同;夹持装置已略去)。
编号 | 实验装置及操作 | 实验现象与结论 |
1 |
| 一段时间内无现象。 |
2 |
| 紫色石蕊试液变红,_____成立。 |
3 |
| _____,猜想II成立。综上猜想III成立。 |
(拓展与思考)
(1)需在装置A、B之间增加装置C.装置C的作用是_____,装置C中药品应具有的性质是_____。
(2)将实验1的稀盐酸改为浓盐酸,紫色石蕊试液变红,说明浓盐酸具有的物理性质是_____。
(3)有同学认为实验1可以省去不做也可以验证猜想。你的观点是_____(填“能”或“不能”)验证猜想。
【题目】甲、乙、丙三种物质只通过一步反应,不能实现如图所示的转化关系的是( )

甲 | 乙 | 丙 | |
A | C | CO | CO2 |
B | CuO | Cu | Cu(NO3)2 |
C | CaCO3 | CO2 | H2O |
D | H2SO4 | H2 | H2O |
A. AB. BC. CD. D