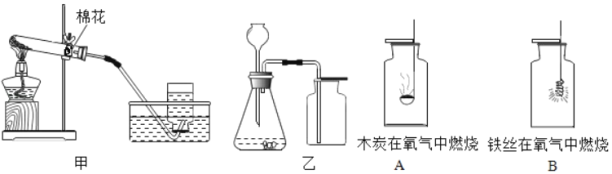
题目内容
【题目】T1℃时, 将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后观象如图一所示。硝酸钾和氯化钾的溶解变曲线如图二所示。下列说法错误的是
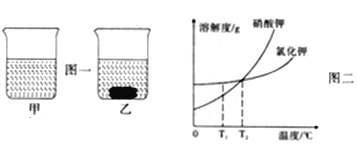
A. 烧杯乙中上层清液是饱和溶液
B. 烧杯甲中溶解的溶质是氯化钾
C. 烧杯甲溶液中溶质的质量分数大于烧杯乙溶液中溶质的质量分数
D. 将温度由T1℃升高到T2℃,充分搅拌,烧杯乙中固体不一定全部溶解
【答案】D
【解析】根据所学知识和题中信息知,A、烧杯乙中上层清液一定是饱和溶液,有未溶解晶体,故A正确;B、烧杯甲中溶解的溶质是氯化钾,T1℃时氯化钾溶解度大于硝酸钾,故B正确;C、烧杯甲溶液中溶质的质量分数大于烧杯乙溶液中溶质的质量分数,由于等质量的硝酸钾和氯化钾分别加入到100g水中,甲中全部溶解,乙中部分溶解,故C正确;D、将温度由T1℃升高到T2℃,充分搅拌,烧杯乙中固体一定全部容解,硝酸钾溶解度随温度的升高而增大,由于等质量的硝酸钾和氯化钾分别加入到100g水中,T1℃时氯化钾溶解度大于硝酸钾,氯化钾已全部溶解,T2℃时硝酸钾溶解度大于氯化钾,硝酸钾也一定会全部溶解,故D错误
点睛∶溶解度曲线的意义①表示同一种物质在不同温度时的溶解度或溶解度随温度变化的情况;②表示不同物质在同一温度时的溶解度,可以比较同一温度时,不同物质的溶解度的大小。若两种物质的溶解度曲线相交,则在该温度下两种物质的溶解度相等;③根据溶解度曲线可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;④根据溶解度曲线能进行有关的计算。

【题目】如表是某品牌500毫升装矿泉水标签的一部分,回答相关问题。
天然矿物质含量:mg/L
偏硅酸 | 25.0~70.0 |
钠 | 1.0~25.0 |
镁 | 0.1~15.0 |
钾 | 0.5~10.0 |
钙 | 2.0~35.0 |
溶解性总固体 | 50.0~250.0 |
(1)表中的钠、镁、钾、钙都是指_____。(选填“分子”、“原子”或“元素”)
(2)喝一瓶该矿泉水,最多摄入的偏硅酸的质量为_____mg。
(3)生产矿泉水时,对于水中的不溶性固体,可以通过_____的方法去除。
(4)可以使用_____来检验该矿泉水是硬水还是软水;生活中通常使用煮沸的方法降低水的硬度,在煮沸过程中,溶解在水中的碳酸氢钙[Ca(HCO3)2]分解成碳酸钙、水和二氧化碳,请写出该反应的化学方程式_____。