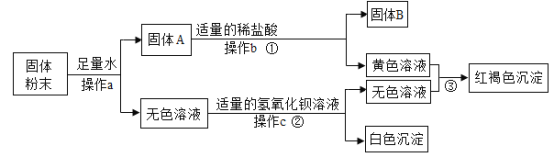
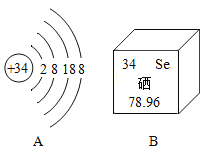
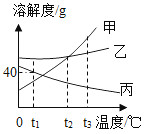
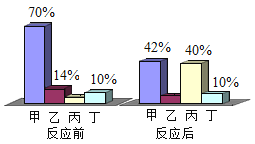
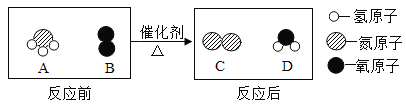
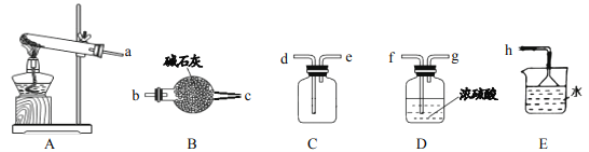
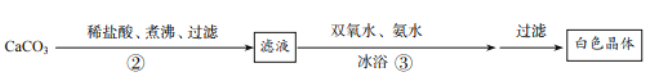
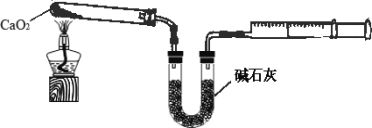
0 205118 205126 205132 205136 205142 205144 205148 205154 205156 205162 205168 205172 205174 205178 205184 205186 205192 205196 205198 205202 205204 205208 205210 205212 205213 205214 205216 205217 205218 205220 205222 205226 205228 205232 205234 205238 205244 205246 205252 205256 205258 205262 205268 205274 205276 205282 205286 205288 205294 205298 205304 205312 211419