题目内容
【题目】若分别将100gt3°C时甲、乙、丙的饱和溶液降温至t1°C,对所得的三种溶液的说法正确的是_____。
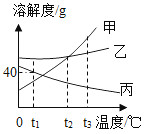
A. 甲、乙、丙都是饱和溶液
B. 所含溶剂质量:甲<乙<丙
C. 溶质质量分数:乙>甲=丙
D. 溶液质量:_____。
【答案】B 丙>乙>甲
【解析】
A、分别将100gt3°C时甲、乙、丙的饱和溶液降温至t1°C,丙物质的溶解度增大,变成不饱和溶液,选项错误;
B、t3°C时,甲物质的溶解度最大,丙物质的溶解度最小,所以100gt3°C时甲、乙、丙的饱和溶液中,丙中溶剂最多,甲中的溶剂最少,降低温度,不会影响溶剂的质量,所以所含溶剂质量:甲<乙<丙,选项正确;
C、t1°C,乙物质的溶解度最大,甲物质的溶解度最小,降低温度,甲、乙物质的溶解度减小,丙物质的溶解度增大,应该按照t3°C时的溶解度计算,所以溶质质量分数:乙>甲>丙,选项错误;
D、降低温度,丙物质不会析出晶体,甲物质的溶解度受温度变化影响较大,甲析出晶体的质量大于乙析出晶体的质量,所以溶液质量:丙>乙>甲;故选B,故填丙>乙>甲。

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目