题目内容
【题目】磷酸铁锂(LiFePO4)电池具有稳定性高、安全、对环境友好等优良性能,是目前最具有发展前景的锂电池正极材料。实验室可利用绿矾(FeSO4·7H2O)和磷酸(H3PO4)为原料制备LiFePO4,其流程如下图所示。已知磷酸铁(FePO4)是一种难溶于水的白色固体。
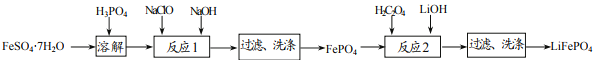
试回答下列问题:
(1)NaClO中氯元素的化合价为_____价。
(2)“溶解”步骤时H3PO4不宜过量太多的原因是_____。
(3)过滤操作中用到的玻璃仪器有:烧杯、玻璃棒和_____。
(4)取反应1最后一次洗涤后的滤液,依次滴加硝酸银溶液和稀硝酸,有白色沉淀生成,则滤液中肯定含有的物质是_____。
(5)请你完成“反应2”总反应的化学方程式。
2LiOH+6H2C2O4+2FePO4=2LiFePO4+7CO2↑+5_____+7H2O(在空格中填写正确的化学式)。
【答案】+1 防止后续反应中消耗氢氧化钠,浪费原料 漏斗 氯化钠 CO↑
【解析】
(1)根据在化合物中正负化合价代数和为零,钠元素的化合价为+1,氧元素的化合价为-2,可得NaClO中氯元素的化合价为:(+1)+x+(-2)=0, x=+1;
(2)氢氧化钠能与磷酸发生中和反应。“溶解”步骤时H3PO4不宜过量太多的原因是防止后续反应中消耗氢氧化钠,浪费原料;
(3)过滤操作中用到的玻璃仪器有:烧杯、玻璃棒和漏斗;
(4)氯化钠溶液能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,取反应1最后一次洗涤后的滤液,依次滴加硝酸银溶液和稀硝酸,有白色沉淀生成,则滤液中肯定含有的物质是NaCl;
(5)根据质量守恒定律可知,化学反应中原子的种类和数目不变,可将化学方程式配平,
2LiOH+6H2C2O4+2FePO4=2LiFePO4+7CO2↑+5CO↑+7H2O。在空格中的化学式为CO。