题目内容
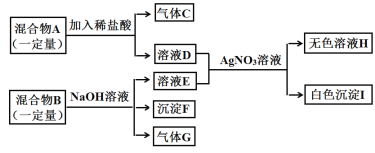
【题目】有一包固体粉末,可能含有铜、氧化铁、氯化钠、硫酸钠、硫酸铜中的一种或几种,为确定其成分进行了如下实验,现象如图所示(部分生成物未标出)。
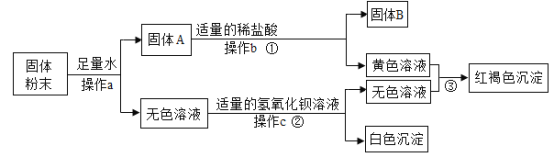
根据实验过程中的现象判断:
(1)固体B的成分是_____(填化学式);操作a、b、c为同一操作,其名称是_____,该操作需要的玻璃仪器烧杯、漏斗、_____。
(2)固体粉末中一定不含有的物质是____(填化学式,下同),可能含有的物质是_____;
(3)写出反应③的化学方程式_____。
【答案】Cu 过滤 玻璃棒 CuSO4 NaCl FeCl3+3NaOH=Fe(OH)3↓+3NaCl
【解析】
固体粉末中加入足量的水溶解,得到固体A和无色溶液,硫酸铜在溶液中显蓝色,所以固体粉末中一定不含硫酸铜;固体A加入足量的盐酸得到固体B和黄色溶液,氧化铁和盐酸反应会生成黄色的氯化铁溶液,所以B是铜,固体粉末中含有铜、氧化铁;无色溶液加入氢氧化钡会生成白色沉淀,所以固体粉末中一定含有硫酸钠,硫酸钠和氢氧化钡反应生成硫酸钡沉淀和氢氧化钠。氯化铁和氢氧化钠反应会生成红褐色的氢氧化铁沉淀。
(1)由分析可知,固体B的成分是铜,铜的化学式为Cu,故填Cu;
a、b、c是同一操作,可以将不溶性固体从溶液中分离出来,其名称是过滤,故填过滤;
过滤操作中需要的玻璃仪器烧杯、漏斗、玻璃棒,故填玻璃棒。
(2)通过推导可知,固体粉末中一定不含有的物质是CuSO4,故填CuSO4;
由上述实验不能确定氯化钠是否存在,所以可能含有的物质是氯化钠,其化学式为NaCl,故填NaCl。
(3)反应③是氢氧化钠和氯化铁反应生成氢氧化铁沉淀和氯化钠,故反应的化学方程式写为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl。

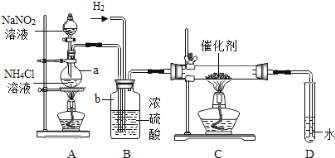
【题目】如图是测定某赤铁矿粉中Fe2O3质量分数的实验装置:
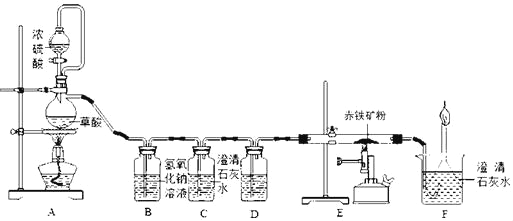
(1)A装置的作用是制取一氧化碳,反应的化学方程式为H2C2O4 =CO2↑+CO↑+H2O.根据反应装置判断,化学方程式中还缺少的条件是_____。
(2)C装置的作用是_____,D装置中药品的名称是_____,E装置中发生反应的化学方程式为_____,F处将尾气燃烧掉的目的是_____。
(3)实验过程中应该先点燃A处还是E处的加热装置?_____。
(4)实验中记录的数据如下表,据此计算赤铁矿中氧化铁的质量分数为_____。
玻璃管质量 | 玻璃管和药品反应前质量 | 玻璃管和药品反应后质量 |
71.8g | 81.8g | 79.4克 |
(5)有同学提出可以根据F装置中增加的质量来计算赤铁矿中氧化铁的质量,你同意此看法吗?说出你的观点和理由是_____。
【题目】如图所示,广口瓶中盛有气体X,胶头滴管中盛有液体Y,若挤压胶头滴管使液体滴入广口瓶中,振荡,一段时间后可见小气球a膨胀鼓起。下表中的各组物质不会出现上述现象的是( )
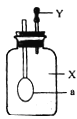
X | Y | |
A | CO | Ca(OH)2溶液 |
B | CO2 | NaOH溶液 |
C | HCl | Ca(OH)2溶液 |
D | SO2 | NaOH溶液 |
A. AB. BC. CD. D