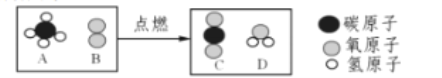
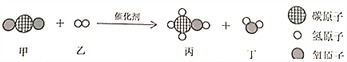
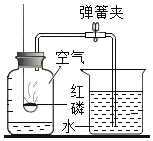
题目内容
【题目】过氧化钙(CaO2)是一种白色无毒的固体,微溶于水,溶于酸,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法:
(Ⅰ)氨气的制备
(查阅资料)
①实验室常用加热氯化铵和熟石灰固体混合物的方法制取氨气;
②氨气极易溶于水,所得溶液称为氨水。
③碱石灰的主要成分是氧化钙和氢氧化钠的混合物。
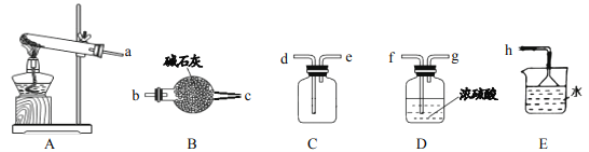
(1)实验室制取氨气的化学方程式_____。
(2)如需收集一瓶干燥的氨气,请选择上图中合适的装置,装置连接顺序为:a→_____→_____→_____→_____→h(按气流方向,用小写字母填空)。
(Ⅱ)碳酸钙的制备

(1)铁的氧化物主要成分为氧化铁,写出氧化铁和盐酸反应的化学方程式_____。
(2)步骤①加入双氧水的目的是使溶液中的Fe2+转化为Fe3+,加入氨水使铁离子形成沉淀,则滤渣的主要成分为_____(填化学式),小火煮沸的作用是使沉淀颗粒长大,有利于_____。
(Ⅲ)过氧化钙的制备
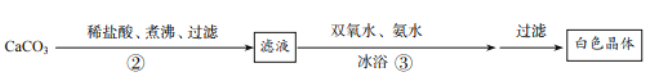
(1)步骤②的具体操作为逐滴加入稀盐酸直至过量。将溶液煮沸的作用是_____。
(2)步骤③是氯化钙和过氧化氢反应制取过氧化钙,则反应的化学方程式为_____,加入氨水的目的是_____,该反应需要在冰浴下进行,原因是_____。
(3)某同学认为,将石灰石煅烧后,直接加入双氧水反应,过滤后即可得到过氧化钙产品,使用该制备工艺的主要缺点是_____。
(4)已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
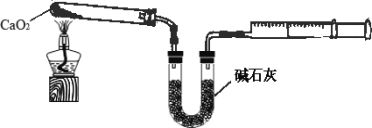
若所取产品质量是0.5g,测得气体体积为60.0mL(该温度下氧气密度为1.6g/L),则产品中CaO2的质量分数为多少_____(写出计算过程)?
【答案】2NH4Cl+Ca(OH)2===CaCl2+2NH3↑+2H2O b c e d Fe2O3+6HCl===2FeCl3+3H2O Fe(OH)3 除去氢氧化铁沉淀(或过滤更充分) 除去过量的稀盐酸 CaCl2+H2O2===CaO2+2HCl 中和掉生成的HCl 防止H2O2分解或氨水挥发 产品纯度不高,杂质含量过多 86.4%(详见解析)
【解析】
(Ⅰ)氨气的制备
(1)实验室常用加热氯化铵和熟石灰固体混合物的方法制取氨气,加热氯化铵和熟石灰固体反应生成氯化钙、水和氨气,化学方程式为:2NH4Cl+Ca(OH)2===CaCl2+2NH3↑+2H2O;
(2)加热氯化铵和熟石灰固体制得的氨气中存在水蒸气,浓硫酸能与氨气反应生成硫酸铵,不能用浓硫酸干燥氨气,氢氧化钠固体具有吸水性,可用B装置干燥氨气,使用B装置干燥气体时,应从b端通入,c端导出,氨气的密度小于空气,使用C装置收集氨气时,应从e 端通入,d端导出。如需收集一瓶干燥的氨气,请选择上图中合适的装置,装置连接顺序为:a→b→c→e→d→h;
(Ⅱ)碳酸钙的制备
(1)铁的氧化物主要成分为氧化铁,氧化铁和盐酸反应生成氯化铁和水,化学方程式为:Fe2O3+6HCl===2FeCl3+3H2O ;
(2)步骤①加入双氧水的目的是使溶液中的Fe2+转化为Fe3+,加入氨水使铁离子形成沉淀,氨水中存在氢氧根离子,铁离子与氢氧根离子可形成氢氧化铁沉淀。则滤渣的主要成分为Fe(OH)3;小火煮沸的作用是使沉淀颗粒长大,有利于除去氢氧化铁沉淀(或过滤更充分);
(Ⅲ)过氧化钙的制备
(1)盐酸具有挥发性,加热可除去盐酸。步骤②的具体操作为逐滴加入稀盐酸直至过量。将溶液煮沸的作用是除去过量的稀盐酸;
(2)氯化钙和过氧化氢反应生成过氧化钙和盐酸,步骤③是反应的化学方程式为CaCl2+H2O2===CaO2+2HCl;氨水能与盐酸反应生成物氯化铵和水,加入氨水的目的是中和掉生成的HCl;过氧化氢在较高温度能分解,氨水在较高温度易挥发,该反应需要在冰浴下进行,原因是防止H2O2分解或氨水挥发;
(3)将石灰石煅烧后,直接加入双氧水反应,过滤后即可得到过氧化钙产品,使用该制备工艺的主要缺点是产品纯度不高,杂质含量过多;
(4)根据题意可知,反应过程中测得气体体积为60.0mL,说明反应过程中生成氧气的体积为60.0mL,生成的氧气质量=0.06L×1.6g/L=0.096g;
设:生成0.096g氧气需要CaO2的质量为x。
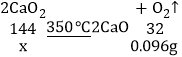
![]() x=0.432g;
x=0.432g;
产品中CaO2的质量分数=![]() 。
。 ![]()

【题目】学习了CO2的有关知识之后,同学们查阅资料发现Mg能在CO2中燃烧:2Mg+CO2![]() 2MgO+C,所以镁着火不能用CO2来灭火。但没有找到有关钠能否与CO2反应的介绍。于是同学们展开钠着火能否用CO2来灭火的探究。
2MgO+C,所以镁着火不能用CO2来灭火。但没有找到有关钠能否与CO2反应的介绍。于是同学们展开钠着火能否用CO2来灭火的探究。
(提出猜想)钠能发生类似于CO2与镁的反应,可能的化学方程式为:_____。
(实验)将燃着的钠伸入装有CO2的集气瓶中,钠能在CO2中继续燃烧。
(查阅资料)
(1)Na2O是白色固体,能与CO2反应生成Na2CO3,与H2O反应生成NaOH。
(2)Ba(OH)2溶于水而BaCO3不溶于水。
(3)Na2CO3的存在会干扰NaOH的检测。
基于以上资料,同学们认为钠在CO2中燃烧的产物应该与Mg在CO2中燃烧的产物情况有所不同,并对产物提出了以下几种猜想:
①Na2O、C;②_____、C;③NaOH、C;④Na2O、Na2CO3、C。
通过理论分析,猜想_____(填序号)肯定是错误的,理由是_____。
(验证猜想)
步骤 | 实验操作 | 主要实验实验现象 | 结论 |
(1) | 将产物溶于适量水中 | 部分溶解,试管底部有黑色固体 | 狂想④正确 |
(2) | 取少量(1)所得上层清液,加入过量的BaCl2溶液 | _____ | |
(3) | 取(2)所得少量上层清液,加入_____ | 溶液变红色 |
步骤(2)中BaCl2溶液发生反应的化学方程式:_____。