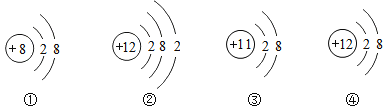
【题目】下表为元素周期表中某一周期元素的原子结构示意图。请回答下列问题:
元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
元素符号 | Na | Mg | Al | Si | P | S | Cl | Ar |
原子结构示意图 |
|
|
|
|
|
|
|
|
(1)表中磷原子的核电荷数x=_________
(2)表中具有相对稳定结构的元素是_________
(3)在化学反应中,每个铝原子失去_________个电子形成铝离子
(4)镁元素与氯元素形成的化合物化学式为_________
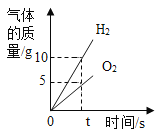
【题目】实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的化学方程式:________________。
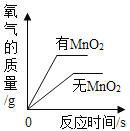
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂。(完成实验)按下表进行实验,并测定分解温度(分解温度越低,催化效果越好)。
实验标号 | 实验药品 | 分解温度(℃) |
① | KCI03 | 580 |
② | KCIO3、MnO2(质量比1:1) | 350 |
③ | KClO3、CuO(质量比1:1) | 370 |
④ | KClO3、Fe203(质量比1:1) | 390 |
(分析数据、得出结论)
(1)由实验________与实验④对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是________。
(反思)
(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后的质量和__________不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证。
[提出猜想]质量相同的催化剂,颗粒越细,催化效果越好。
[设计实验]___________________________________________
[结论与反思]颗粒越细,与反应物接触面积越大,催化效果越好。
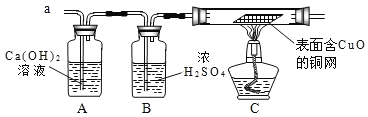
【题目】常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。

(1)试管尾部放一团湿棉花的作用是____________。
(2)探究生成的气体是什么?用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是_________________。
(3)探究试管中剩余固体成分是什么?
(查阅资料)
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
金属氧化物可以与酸反应,生成水和另一种金属化合物(如:CuO+2HCl=CuCl2+H20)。
(初步验证)试管中剩余固体为黑色,能全部被磁铁吸引。
(猜想与假设)猜想一:剩余固体是Fe与Fe3O4;
猜想二:剩余固体是__________。
(实验探究)
实验操作 | 实验现象 | 结论 |
取少量黑色固体于试管中,加入足量的稀盐酸。 | ________________ | 猜想一正确 |
________________ | 猜想二正确 |
(实验结论)铁和水蒸气反应的化学方程式为_____________。
(反思与交流)该黑色固体不可能是Fe2O3,理由是_____________。