题目内容
【题目】化学兴趣小组同学将铝丝插入硫酸铜溶液中时,发现生成红色固体物质的同时有较多的气泡放出。生成了什么气体?同学们决定进行探究。
(提出猜想)放出的气体可能是SO2、O2、H2的一种或几种,提出猜想的依据是___________。
(查阅资料)SO2易溶于水,化学性质与二氧化碳有相似之处,它也能使澄清石灰水变浑浊,生成的是水和不溶于水的亚硫酸钙(CaSO3)。
浓硫酸吸收水分,可作气体的干燥剂。
(方案设计)依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是___________。
经检验,确认不是O2。
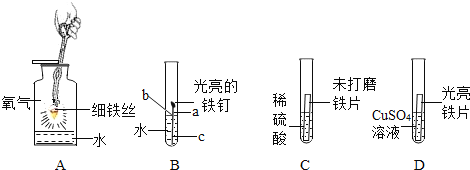
(2)实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体。
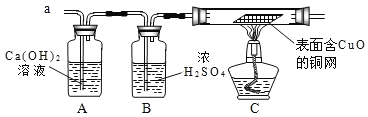
(实验探究)实验开始时,先将收集到的气体从a通入一段时间后,再点燃C处酒精灯:这样操作的目的是________________。
实验过程中发现A装置中溶液不变浑浊,C装置中表面含CuO的铜网由黑色变为光亮的红色。
(结论)铝丝与硫酸铜溶液反应时,产生的气体是_________。该气体与氧化铜的反应的化学方程式为_______________。
(思维拓展)由上述实验可以推出,硫酸铜溶液中可能含有_______。
【答案】质量守恒定律,反应前后元素种类不变 将带火星的木条伸入该气体,木条不复燃 排尽装置内空气防止发生爆炸 H2 CuO+H2![]() Cu+H2O 稀硫酸
Cu+H2O 稀硫酸
【解析】
提出猜想:
根据质量守恒定律,反应前后元素种类不变,铁粉投入硫酸铜溶液中,反应前含有S、O、H、Cu等元素,可能生成的气体只能是SO2、O2、H2中的一种或几种;
方案设计:
(1)氧气具有助燃性,可以把带火星的木条伸入试管中,若木条复燃则是氧气;木条不复燃,不是氧气;
(2)可燃性的气体和空气混合加热时可能会发生爆炸,因此先将收集到的气体从a通入一段时间后,再点燃C处酒精灯的目的是排出装置内的空气,以防加热时爆炸;
实验结论:
A装置中溶液不变浑浊,说明没有二氧化硫,H2可以使CuO还原成红色的Cu,故产生的气体为氢气;化学方程式为:CuO+H2![]() Cu+H2O;
Cu+H2O;
思维拓展:因为有氢气生成,铝应该与酸反应产生氢气,故硫酸铜溶液中可能含有稀硫酸。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案