【题目】为探究锌、铜、铬三种金属的性质,某兴趣小组进行如下实验。
【实验一】将三种金属丝分别与一节干电池和小电珠连接,小电珠发光。
【实验二】取粗细、长短相同的锌丝、铜丝、铬丝均与50mL稀硫酸反应,实验记录如下:
锌 | 铜 | 铬 | 铜 | |
稀硫酸的质量分数 | 5% | 5% | 15% | 15% |
反应现象 | 少量气泡 | 无现象 | 许多气泡 | 无现象 |
【实验三】金属锌、铜和稀硫酸构成如图所示的化学电池装置,观察到铜片表面有气泡(H2),小电珠发光。

(1)实验一的现象说明三种金属都具有____________性;
(2)铬与稀硫酸反应生成硫酸亚铬(CrSO4)和氢气,反应的化学方程式是______________________________________;该反应属于________________(填基本反应类型)反应;
(3)要判断三种金属活动性强弱,必须在实验二的基础上增补一个实验才能得出结论,其实验内容是把粗细、长短相同的________________放入________________的50mL稀硫酸中,观察放出气泡的快慢;
(4)金属活动性强弱是由金属物质的结构决定的,不会因某个实验而改变。下列关于实验三分析正确的是______(填序号)。
A.铜的金属活动性变得比锌强
B.铜与稀盐酸发生了置换反应
C.该装置将化学能转化为电能
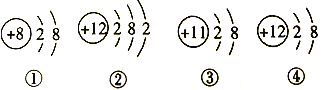
【题目】某兴趣小组通过镁与稀盐酸反应探究影响反应速率的因素(镁的质量相等,镁条的形状一样,稀盐酸均过量),设计实验如表:
实验编号 | 盐酸的质量分数 | 镁的形态 | 溶液初始温度/℃ |
① | 3% | 粉末 | 30 |
② | 3% | 条状 | 20 |
③ | 6% | 粉末 | 20 |
④ | 6% | 条状 | 20 |
(1)镁与稀盐酸反应的化学方程式为______。
(2)若四组实验均以收集到250mL氢气为标准,要比较各组反应速率,则以上实验还需要测出的数据是______。
(3)实验______和______(填实验编号)是研究盐酸的浓度对该反应速率的影响。
(4)测定在不同时间产生的氢气的体积数据,绘制出图1,则实验②对应的曲线可能是______(填序号)。

(5)利用图2压力传感器进行实验,得到图3锥形瓶内的压强随时间变化的曲线图,发现实验测得的实际值比理论值偏大。请分析可能的原因______。