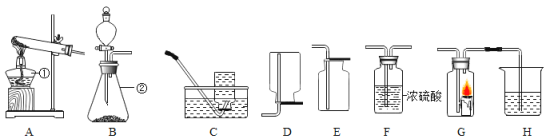
题目内容
【题目】海水是一种重要的自然资源,图1是对海水的部分利用。

(1)请写出光分解水的反应化学方程式______。
(2)结合图2氯化钠的溶解度曲线分析,从海水中获得粗盐常用的结晶方法是______。
粗盐的初步提纯过程是:溶解→过滤→蒸发,这三步操作中都用到的一种玻璃仪器是______。
(3)20℃时氯化钠的饱和溶液中溶质和溶剂的质量比为______。
(4)欲将t℃时氯化钠溶液的状态从a点转化为b点,可采用的一种方法是______。
【答案】2H2O![]() O2↑+2H2↑ 蒸发结晶 玻璃棒 9:25 加氯化钠
O2↑+2H2↑ 蒸发结晶 玻璃棒 9:25 加氯化钠
【解析】
(1)水分解生成氢气和氧气,反应化学方程式:2H2O![]() O2↑+2H2↑,故填2H2O
O2↑+2H2↑,故填2H2O![]() O2↑+2H2↑;
O2↑+2H2↑;
(2)海水中获得粗盐常用的结晶方法是蒸发结晶,故填蒸发结晶;粗盐的初步提纯过程是溶解→过滤→蒸发,这三步操作中都用到的一种玻璃仪器是玻璃棒,故填玻璃棒;
(3)20℃时氯化钠的溶解度为36g,即20℃时100g水中溶解36g氯化钠达到饱和,所以20℃时氯化钠的饱和溶液中溶质和溶剂的质量比为=36:100=9:25,故填9:25;
(4)a点转化为b点是使氯化钠的不饱和溶液变为饱和溶液,所以欲将t℃时氯化钠溶液的状态从a点转化为b点,可采用加氯化钠,或蒸发溶剂,故填加氯化钠。

【题目】在实验室制取氧气时,取MnO2和KClO3的固体混合物15.25g,加热至不再产生气体为止,收集到一定质量的氧气。某化学兴趣小组欲求得所制氧气的质量,他们将加热后剩余物冷却到一定温度后,通过多次加水测定剩余物质量的办法即可求出。加水的质量与剩余固体的质量见下表:(MnO2是不溶于水的固体粉末)
编号 | 1 | 2 | 3 | 4 |
加水的质量(g) | 10 | 10 | 10 | 10 |
剩余固体的质量(g) | 7.25 | 4.05 | m | 3 |
试求:
(1)表中m值为_____;
(2)混合物中KClO3的质量_____;
(3)所制得氧气的质量____恰好完全反应后固体中氯化钾的质量分数____(写出具体计算过程,质量分数保留0.01%)。
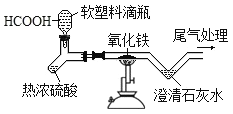
【题目】在中学生“我与化学“活动中,小青以月饼食品中的“脱氧剂”![]() 如图
如图![]() 为主题,组成小组开展探究。
为主题,组成小组开展探究。

(查阅资料)脱氧剂的工作原理是:在一定条件下,铁与空气中的氧气、水等物质发生氧化反应,把月饼包装中的氧气除去。
![]() (观察与思考)小青收集的脱氧剂是塑料袋包装,上面有许多小孔。这些小孔的作用是______。
(观察与思考)小青收集的脱氧剂是塑料袋包装,上面有许多小孔。这些小孔的作用是______。
![]() (知识回顾)碳充分燃烧和不充分燃烧的产物是不同的,写出碳不充分燃烧的化学方程式:______。
(知识回顾)碳充分燃烧和不充分燃烧的产物是不同的,写出碳不充分燃烧的化学方程式:______。
![]() (实验探究)剪开塑料袋,将脱氧剂中的物质倒在白纸上,观察,为黑色粉末。
(实验探究)剪开塑料袋,将脱氧剂中的物质倒在白纸上,观察,为黑色粉末。
进一步查阅资料知:
脱氧剂的成分为:活性炭、铁粉、氯化钠。
检验氯化钠的反应的化学方程式为:![]() 。
。
取适量脱氧剂在烧杯中,加足量水,充分搅拌,过滤,得到黑色滤渣和无色滤液。进一步探究如下表![]() 请填写实验现象
请填写实验现象![]() :
:
编号 | 实验操作 | 实验现象 |
| 取少量黑色滤渣在空气中烧灼,上方用蘸有澄清石灰水的玻璃棒实验,观察 | ______ |
| 取少量黑色滤渣于试管中,向其中加入足量稀盐酸,观察 | ______ |
| 取少量无色滤液于试管中,往其中加入硝酸银溶液,观察 | ______ |
(结论)脱氧剂中含有:活性炭、铁粉、氯化钠。
【题目】归纳与反思是学习化学的重要环节。下列各项归纳完全正确的是![]()
![]()
|
|
氧气有助燃性:用作燃料 增加粮食产量:施用过量化肥、农药 一氧化碳有还原性:用于冶炼金属 | 核电荷数最小的原子:H 地壳中含量最高的金属元素:铁 天然存在的最硬的物质:金刚石 |
|
|
鉴别软水和硬水:肥皂水 除去冰箱中的异味:活性炭吸附 生活中使用乙醇汽油:无污染 | 氧气:由氧气分子构成 金属铜:由铜原子构成 氯化钠:由 |
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()