题目内容
【题目】铁和铜在生产、生活中应用广泛。
(1)电路中经常用铜作导线,这是利用其良好的______性。
(2)建造港珠澳大桥需要大量的钢铁,工业上可用一氧化碳和赤铁矿石(主要成分是氧化铁)反应来炼铁,其反应的化学方程式为______。
(3)港珠澳大桥钢管桩涂上高性能涂层可防止生锈,其原理是______。
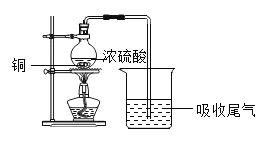
(4)某工厂将生产过程中产生的含铜废料进行回收并合理应用:
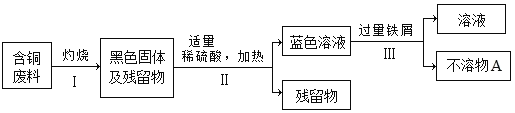
①将步骤Ⅱ反应的化学方程式补充完整:______+H2SO4![]() CuSO4+H2O
CuSO4+H2O
②古代“湿法冶金”的原理与图中步骤______(填“Ⅰ”、“Ⅱ”或“Ⅲ”)的反应原理相同。
③利用化学方法从“不溶物A”中提纯铜单质:______(用化学方程式表示)。
【答案】导电 Fe2O3+3CO![]() 2Fe+3CO2 与氧气和水隔绝 CuO Ⅲ Fe+H2SO4=FeSO4+H2↑
2Fe+3CO2 与氧气和水隔绝 CuO Ⅲ Fe+H2SO4=FeSO4+H2↑
【解析】
(1)电路中经常用铜作导线,这是利用其良好的导电性,故填导电;
(2)高温条件下氧化铁和一氧化碳反应生成铁和二氧化碳,其反应的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2,故填Fe2O3+3CO
2Fe+3CO2,故填Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(3)港珠澳大桥钢管桩涂上高性能涂层可防止生锈,其原理是与氧气和水隔绝,故填与氧气和水隔绝;
(4)
①高温条件下,氧气和铜反应生成氧化铜,氧化铜和稀硫酸反应生成硫酸铜和水,反应的化学方程式为CuO+H2SO4=CuSO4+H2O,故填CuO;
②古代“湿法冶金”的原理是金属单质和盐溶液反应生成盐溶液和金属单质,与Ⅲ中铁和硫酸铜反应生成硫酸亚铁和铜的反应原理相同,故填Ⅲ;
③“不溶物A”中含有铁和铜,提纯铜单质的方法是加入稀硫酸直至不产生气泡为止,铁和稀硫酸反应生成硫酸亚铁和氢气,过滤得到铜,铁和稀硫酸反应的化学方程式为Fe+H2SO4═FeSO4+H2↑,故填Fe+H2SO4═FeSO4+H2↑。

 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】镁、铝、铁等金属与我们生活息息相关。
(1)下表中是镁、铝、铝镁合金的某些物理性质。可见,铝镁形成的合金后性能上发生了的变化之一是:______。
金属 | 镁 | 铝 | 铝镁合金 |
熔点/℃ | 649 | 660 | 463 |
硬度 | 2.0 | 2.75 | 3-4 |
(2)钢铁制作的自行车车架表面喷漆可以防锈,其原理是______。
(3)铝壶内的水垢不能用稀盐酸长时间浸泡,其原因是______。(用化学方程式表示)
(4)我国用铼合金制造飞机发动机叶片的技术取得重大突破,冶炼铼的化学方程式为2KReO4+7H2![]() 2Re+6M+2KOH,M的化学式是______。
2Re+6M+2KOH,M的化学式是______。
【题目】为探究锌、铜、铬三种金属的性质,某兴趣小组进行如下实验。
【实验一】将三种金属丝分别与一节干电池和小电珠连接,小电珠发光。
【实验二】取粗细、长短相同的锌丝、铜丝、铬丝均与50mL稀硫酸反应,实验记录如下:
锌 | 铜 | 铬 | 铜 | |
稀硫酸的质量分数 | 5% | 5% | 15% | 15% |
反应现象 | 少量气泡 | 无现象 | 许多气泡 | 无现象 |
【实验三】金属锌、铜和稀硫酸构成如图所示的化学电池装置,观察到铜片表面有气泡(H2),小电珠发光。

(1)实验一的现象说明三种金属都具有____________性;
(2)铬与稀硫酸反应生成硫酸亚铬(CrSO4)和氢气,反应的化学方程式是______________________________________;该反应属于________________(填基本反应类型)反应;
(3)要判断三种金属活动性强弱,必须在实验二的基础上增补一个实验才能得出结论,其实验内容是把粗细、长短相同的________________放入________________的50mL稀硫酸中,观察放出气泡的快慢;
(4)金属活动性强弱是由金属物质的结构决定的,不会因某个实验而改变。下列关于实验三分析正确的是______(填序号)。
A.铜的金属活动性变得比锌强
B.铜与稀盐酸发生了置换反应
C.该装置将化学能转化为电能