1.如图所示实验装置进行的相应实验,达不到实验目的是( )


| A. | 在实验室中,用图1所示装置除去少量黄河水中的泥沙 | |
| B. | 用图2所示装置除去CO2中含有的少量HCl气体 | |
| C. | 用图3所示装置制取少量CO2气体 | |
| D. | 用图4所示装置稀释浓硫酸 |
20.下列化学用语表达错误的是( )
| A. | 尿素的化学式:CO(NH2)2 | |
| B. | 氧原子的结构示意图: | |
| C. | 铁锈和盐酸反应的化学方程式:Fe2O3+6HCl═2FeCl2+3H2O | |
| D. | 过氧化氢中氢、氧元素的化合价:${\;}_{{H}_{2}}^{+1}$${\;}_{{O}_{2}}^{-1}$ |
18.用分子的观点对下列现象解释错误的是( )
| A. | 花香四溢--分子在不断运动 | B. | 酿制美酒--分子本身发生改变 | ||
| C. | 空气液化--分子间间隔改变 | D. | 汽油挥发--分子体积变大 |
17.下列物质由离子构成的是( )
| A. | 氢气 | B. | 氯化钠 | C. | 水 | D. | 二氧化碳 |
16.如图所示的实验操作或装置正确的是( )
| A. |  检查装置气密性 | B. |  振荡试管 | C. |  稀释浓硫酸 稀释浓硫酸 | D. |  测溶液PH值 |
15. 某兴趣小组,在空气中点燃镁条时,发现在生成的白色固体物质中夹杂着少量的淡黄色固体.为了探究其原因,小组成员进行了以下探究活动:
某兴趣小组,在空气中点燃镁条时,发现在生成的白色固体物质中夹杂着少量的淡黄色固体.为了探究其原因,小组成员进行了以下探究活动:
【提出问题】淡黄色固体物质的成分是什么?
【查阅资料】得知,空气与氮气的密度很接近,下列几种物质的颜色分别为:
小组成员一致认为产物中一定不含有氯化镁,理由是根据质量守恒定律,空气中不含有氯元素,所以一定不含氯化镁.
【提出猜想】淡黄色的固体可能是Mg3N2.(填化学式)
【实验探究】(1)按如图所示装置收集氮气(关闭活塞和止水夹,用凸透镜聚光引燃白磷,待白磷不再燃烧并冷却至室温后,打开分液漏斗的活塞及止水夹,向分液漏斗中不断注水,直到收集满一瓶气体为止.)
(2)点燃白磷的作用是除去装置B中的氧气
(3)用排水法收集好氮气后,接下来的实验操作是将燃着的镁条伸进(1)所收集的氮气的瓶中,若镁条继续燃烧,且有淡黄色固体生成,则证明淡黄色固体是Mg3N2.
【实验结论】经过实验,猜想是正确的.镁条在氮气中燃烧的化学反应符号表示式是3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2.
【实验反思】氮气选用排水法收集的原因是氮气不溶于水且密度与空气的密度很接近.
0 169067 169075 169081 169085 169091 169093 169097 169103 169105 169111 169117 169121 169123 169127 169133 169135 169141 169145 169147 169151 169153 169157 169159 169161 169162 169163 169165 169166 169167 169169 169171 169175 169177 169181 169183 169187 169193 169195 169201 169205 169207 169211 169217 169223 169225 169231 169235 169237 169243 169247 169253 169261 211419
 某兴趣小组,在空气中点燃镁条时,发现在生成的白色固体物质中夹杂着少量的淡黄色固体.为了探究其原因,小组成员进行了以下探究活动:
某兴趣小组,在空气中点燃镁条时,发现在生成的白色固体物质中夹杂着少量的淡黄色固体.为了探究其原因,小组成员进行了以下探究活动:【提出问题】淡黄色固体物质的成分是什么?
【查阅资料】得知,空气与氮气的密度很接近,下列几种物质的颜色分别为:
| 物 质 | 氧化镁 | MgCl2 | 氮化镁 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
| 颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
【提出猜想】淡黄色的固体可能是Mg3N2.(填化学式)
【实验探究】(1)按如图所示装置收集氮气(关闭活塞和止水夹,用凸透镜聚光引燃白磷,待白磷不再燃烧并冷却至室温后,打开分液漏斗的活塞及止水夹,向分液漏斗中不断注水,直到收集满一瓶气体为止.)
(2)点燃白磷的作用是除去装置B中的氧气
(3)用排水法收集好氮气后,接下来的实验操作是将燃着的镁条伸进(1)所收集的氮气的瓶中,若镁条继续燃烧,且有淡黄色固体生成,则证明淡黄色固体是Mg3N2.
【实验结论】经过实验,猜想是正确的.镁条在氮气中燃烧的化学反应符号表示式是3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2.
【实验反思】氮气选用排水法收集的原因是氮气不溶于水且密度与空气的密度很接近.
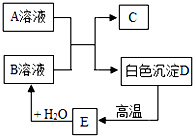 A、B、C、D、E都是初中化学中的常见物质,相互之间存在以下转化关系.其中A是一种盐,广泛用于玻璃、造纸、纺织和洗涤的生产等;D是大理石的主要成分,大量用于建筑业.
A、B、C、D、E都是初中化学中的常见物质,相互之间存在以下转化关系.其中A是一种盐,广泛用于玻璃、造纸、纺织和洗涤的生产等;D是大理石的主要成分,大量用于建筑业.