7.废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),动物饲料硫酸亚铁的生产工艺之一如图所示:
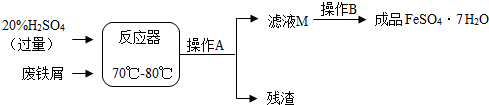
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe═3FeSO4外,写出发生的其他一个化学反应方程式:Fe+H2SO4=FeSO4+H2↑、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)在实验室中操作A是过滤;
(3)滤液M经过操作B可得硫酸亚铁晶体(FeSO4•7H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
根据溶解度表,要得到纯净的硫酸亚铁晶体(FeSO4•7H2O),冷却结晶温度应该低于
64℃;待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次.用冰水洗涤的目的是:
Ⅰ除去晶体表面附着的杂质;Ⅱ减少晶体溶解,提高产率.
(4)在化学反应中,将有元素化合价变化的反应定义为氧化还原反应.在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等.将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它氧化物,试写出该氧化还原反应的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3.
0 168538 168546 168552 168556 168562 168564 168568 168574 168576 168582 168588 168592 168594 168598 168604 168606 168612 168616 168618 168622 168624 168628 168630 168632 168633 168634 168636 168637 168638 168640 168642 168646 168648 168652 168654 168658 168664 168666 168672 168676 168678 168682 168688 168694 168696 168702 168706 168708 168714 168718 168724 168732 211419

(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe═3FeSO4外,写出发生的其他一个化学反应方程式:Fe+H2SO4=FeSO4+H2↑、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)在实验室中操作A是过滤;
(3)滤液M经过操作B可得硫酸亚铁晶体(FeSO4•7H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
64℃;待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次.用冰水洗涤的目的是:
Ⅰ除去晶体表面附着的杂质;Ⅱ减少晶体溶解,提高产率.
(4)在化学反应中,将有元素化合价变化的反应定义为氧化还原反应.在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等.将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它氧化物,试写出该氧化还原反应的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3.




 利用如图所示的装置进行碱式碳酸铜加热分解的实验.试回答:
利用如图所示的装置进行碱式碳酸铜加热分解的实验.试回答: 如图表示的是地壳里所含各种元素的质量分数.请据图回答下列问题;
如图表示的是地壳里所含各种元素的质量分数.请据图回答下列问题;