题目内容
2.在分子、原子、质子、中子、电子这些微粒中:(1)能直接构成物质的微粒有分子、原子;
(2)显示电中性的微粒有分子、原子、中子;
(3)质量最小的微粒是电子;
(4)带正电的微粒有质子;带负电的微粒有电子.
分析 可以根据微观粒子的构成、微观粒子的电性等方面进行分析、判断,从而得出正确的结论.
解答 解:(1)分子、原子能直接构成物质;
(2)中子不带电所以显电中性,因为原子是由带正电的原子核和核外带负电的电子构成,原子核所带电量和核外电子所带电量相等,电性相反,所以整个原子不显电性,又因为分子是由原子构成的,所以分子也不显电性;
(3)一个质子质量约等于一个中子质量都约等于一个电子质量的1836倍,所以质量最小的是电子.
(4)一个质子带一个单位正电荷;一个电子带一个单位的负电荷;
故答案为:(1)分子、原子;
(2)分子、原子、中子;
(3)电子;
(4)质子;电子;
点评 本题主要考查了微观粒子的特点等方面的内容,难度不大,需要加强识记.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案| A. | 干冰用于人工降雨 | B. | 稀有气体用作多用途的电光源 | ||
| C. | 焊接金属时用氮气作保护气 | D. | 铜用于制作导线 |
| A. | 氧气 消毒酒精 | B. | 硫 蒸馏水 | ||
| C. | 氧化铜 硫酸钠 | D. | 氮气 食盐水 |
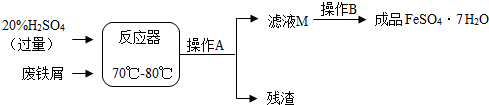
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe═3FeSO4外,写出发生的其他一个化学反应方程式:Fe+H2SO4=FeSO4+H2↑、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)在实验室中操作A是过滤;
(3)滤液M经过操作B可得硫酸亚铁晶体(FeSO4•7H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
64℃;待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次.用冰水洗涤的目的是:
Ⅰ除去晶体表面附着的杂质;Ⅱ减少晶体溶解,提高产率.
(4)在化学反应中,将有元素化合价变化的反应定义为氧化还原反应.在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等.将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它氧化物,试写出该氧化还原反应的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3.
等差量的铁粉与过量的盐酸在不同的实验条件下进行反应,测定在相同时间t产生气体体积V的数据,根据数据绘制得到图1。
组别 | 盐酸的溶质质量分数 | 温度(℃) |
1 | 7 | 30 |
2 | 10 | 50 |
3 | 7 | 20 |
4 | 10 | 30 |

(1)请写出铁粉稀盐酸反应的化学方程式__________________________。
(2)由实验_________(填组别)可知,温度对于金属与酸反应速率的影响是_____。
(3)图1中表示第3组实验的曲线是____________。
[进一步探究]图甲、图乙为利用数字化仪器测得的室温下足量的三种金属片分别与200ml100℅的稀盐酸反应产生氢气的量。(产生氢气的量由气体压强表示,在等温条件下,产生氢气体积与装置内压强成正比)。

①实验中你认为,还要控制的变量是_________________________。
②由图乙,你得出的反应物的量与生成的气体体积的关系是____________。
[拓展提高]下图为测得的室温下足量的镁片与20ml110℅的稀盐酸反应产生氢气的量与时间关系曲线,发现实验测得的实际值比通过计算得到的理论值偏大,请分析可能的原因(至少答两点)。

①_______________________________。
②________________________________________。


 4月6号,福建省漳州市古雷PX项目发生爆炸事故,来自福建各地和广东的消防车迅速扑灭火灾,经过36小时的扑救,4月7日晚,漏油着火的古雷PX项目火势在下午扑灭后又告复燃.原因之一是当时天气风比较大,覆盖的泡沫可能会被风吹开导致起火复燃.同学在在百度百科上锁定“PX”为“低毒化合物”的准确描述,PX是“对二甲苯”,其组成和结构如右图所示,相关性质如下:
4月6号,福建省漳州市古雷PX项目发生爆炸事故,来自福建各地和广东的消防车迅速扑灭火灾,经过36小时的扑救,4月7日晚,漏油着火的古雷PX项目火势在下午扑灭后又告复燃.原因之一是当时天气风比较大,覆盖的泡沫可能会被风吹开导致起火复燃.同学在在百度百科上锁定“PX”为“低毒化合物”的准确描述,PX是“对二甲苯”,其组成和结构如右图所示,相关性质如下: