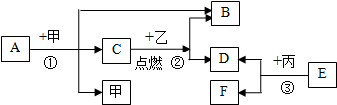
15.下列只能表示微观意义的是( )
| A. | 2S | B. | Ar | C. | O2 | D. | N |
14.下列化学用语表达正确的是( )
| A. | 5个钠离子--5 $\stackrel{+1}{Na}$ | B. | 2个氧原子--O2 | ||
| C. | 1个氮气分子--N2 | D. | 硫酸铁--FeSO4 |
13.在反应2A+B=3C+D中,反应物的质量比为A:B=5:2.若完全反应后生成C和D共2.1g,则消耗反应物A为( )
| A. | 2.1g | B. | 1.5 g | C. | 1.05 g | D. | 0.6g |
12.下列物质中,前者为单质.后者为氧化物的是( )
| A. | 液氧 冰 | B. | 冰 高锰酸钾 | C. | 白磷 空气 | D. | 过氧化氢 氧化镁 |
9.小明吃过瓜子后忘记密封,发现剩下的瓜子变软了,这说明空气中含有( )
| A. | 氮气 | B. | 氧气 | C. | 二氧化碳 | D. | 水蒸气 |
8.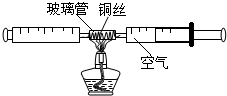 在测定空气中氧气含量的实验中,小强采用了如图所示装置:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化.
在测定空气中氧气含量的实验中,小强采用了如图所示装置:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化.
(1)在实验加热过程中,交替缓慢推动两个注射器活塞的目的是使空气中的氧气充分反应;
(2)写出该实验中反应的化学方程式2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
(3)小强测得实验结果如下:
由此数据可以推算出他测定的空气中氧气的体积分数< 2l%(填“>”、“=”、“<”).造成该实验出现误差的原因可能是①②③;(填序号)
①没有交替缓缓推动两个注射器活塞;②读数时没有冷却至室温;③加入铜丝量太少;④加入铜丝量太多
(4)通过上面的实验,你学到的测量混合物中某成分含量的方法是通过化学反应除去混合物中的一种成分,再测量混合物在反应前后体积(或质量)的变化,从而得出该种成分的含量;
(5)该实验还能说明氮气的化学性质不燃烧,不支持燃烧.
 在测定空气中氧气含量的实验中,小强采用了如图所示装置:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化.
在测定空气中氧气含量的实验中,小强采用了如图所示装置:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化.(1)在实验加热过程中,交替缓慢推动两个注射器活塞的目的是使空气中的氧气充分反应;
(2)写出该实验中反应的化学方程式2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
(3)小强测得实验结果如下:
| 反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
| 25mL | 22mL |
①没有交替缓缓推动两个注射器活塞;②读数时没有冷却至室温;③加入铜丝量太少;④加入铜丝量太多
(4)通过上面的实验,你学到的测量混合物中某成分含量的方法是通过化学反应除去混合物中的一种成分,再测量混合物在反应前后体积(或质量)的变化,从而得出该种成分的含量;
(5)该实验还能说明氮气的化学性质不燃烧,不支持燃烧.
7.做完“铁在氧气里燃烧”实验后,小冬同学有两个疑惑不解的问题,于是她进行了以下探究活动,请你一同参与.
[问题1]铁燃烧时溅落下来的黑色物质中还有没有铁呢?
[查阅资料1]
(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);
(2)铁的氧化物均能溶于酸的溶液.
[实验探究]
将冷却后的黑色物质碾碎,装入试管,加入稀盐酸、硫酸铜等溶液,观察到的现象是冒气泡、生成红色固体等,说明铁燃烧时溅落下来的黑色物质中还含有铁.
[问题2]铁燃烧的产物为什么不是Fe2O3呢?
[查阅资料2]
(1)Fe3O4和Fe2O3的分解温度、铁的熔点见表:
(2)Fe2O3高温时分解成Fe3O4.
[理论探讨]
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在l535℃~l538℃之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4.
[拓展延伸]
(1)实验中为了防止集气瓶炸裂,必须在集气瓶底部放少量的水;反应的化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式6Fe203$\frac{\underline{\;高温\;}}{\;}$4Fe304+02↑;
有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色由黑色变成红棕色,就说明包装盒破损进气,这样售货员就能及时发现并处理.
0 166007 166015 166021 166025 166031 166033 166037 166043 166045 166051 166057 166061 166063 166067 166073 166075 166081 166085 166087 166091 166093 166097 166099 166101 166102 166103 166105 166106 166107 166109 166111 166115 166117 166121 166123 166127 166133 166135 166141 166145 166147 166151 166157 166163 166165 166171 166175 166177 166183 166187 166193 166201 211419
[问题1]铁燃烧时溅落下来的黑色物质中还有没有铁呢?
[查阅资料1]
(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);
(2)铁的氧化物均能溶于酸的溶液.
[实验探究]
将冷却后的黑色物质碾碎,装入试管,加入稀盐酸、硫酸铜等溶液,观察到的现象是冒气泡、生成红色固体等,说明铁燃烧时溅落下来的黑色物质中还含有铁.
[问题2]铁燃烧的产物为什么不是Fe2O3呢?
[查阅资料2]
(1)Fe3O4和Fe2O3的分解温度、铁的熔点见表:
| Fe3O4 | Fe2O3 | 铁 | |
| 分解温度/℃ | 1538 | 1400 | - |
| 熔点/℃ | - | - | 1535 |
[理论探讨]
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在l535℃~l538℃之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4.
[拓展延伸]
(1)实验中为了防止集气瓶炸裂,必须在集气瓶底部放少量的水;反应的化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式6Fe203$\frac{\underline{\;高温\;}}{\;}$4Fe304+02↑;
有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色由黑色变成红棕色,就说明包装盒破损进气,这样售货员就能及时发现并处理.
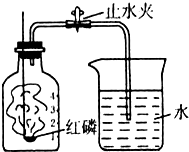 某同学在学习了拉瓦锡测空气中氧气含量的测定方法后,自己设计如图所示的装置,用来测空气中氧气的含量.该同学的实验步骤如下:
某同学在学习了拉瓦锡测空气中氧气含量的测定方法后,自己设计如图所示的装置,用来测空气中氧气的含量.该同学的实验步骤如下: