16. 某钙片的标签如图,且知钙片成分中只有碳酸钙中含有钙元素:
某钙片的标签如图,且知钙片成分中只有碳酸钙中含有钙元素:
(1)请计算碳酸钙中钙元素的质量分数为40%;
(2)请通过计算推断此标签中的含钙量是虚假(填虚假或真实)的;
(3)某实验小组为测定其真实的含钙量做了如下实验,每次取10片钙片放入已称量的含足量盐酸的烧杯中,充分反应后再称取烧杯和剩余物质的总质量,数据如下:请计算此钙片中碳酸钙的质量分数
 某钙片的标签如图,且知钙片成分中只有碳酸钙中含有钙元素:
某钙片的标签如图,且知钙片成分中只有碳酸钙中含有钙元素:(1)请计算碳酸钙中钙元素的质量分数为40%;
(2)请通过计算推断此标签中的含钙量是虚假(填虚假或真实)的;
(3)某实验小组为测定其真实的含钙量做了如下实验,每次取10片钙片放入已称量的含足量盐酸的烧杯中,充分反应后再称取烧杯和剩余物质的总质量,数据如下:请计算此钙片中碳酸钙的质量分数
| 物质的质量 | |
| 反应前:烧杯+盐酸 | 22g |
| 10片钙片 | 8g |
| 反应后:烧杯+剩余物 | 26.7g |
14.学校化学兴趣小组的同学知道二氧化锰能作过氧化氢(H2O2)分解的催化剂后,想再探究其他一些物质如氧化铝是否也可作过氧化氢分解的催化剂.请你一起参与他们的探究过程,并填写下列空白.
【提出问题】Al2O3能不能作过氧化氢分解的催化剂呢?
【作出猜想】Al2O3能作过氧化氢分解的催化剂.
【实验验证】
(1)把表格内容填写完整)①向试管内加适量的过氧化氢溶液;②Al2O3能作过氧化氢分解的催化剂
【得出结论】Al2O3能加快过氧化氢的分解速率,故Al2O3能作过氧化氢分解的催化剂.
(2)【反思提高】经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验:
实验三:
【实验目的】探究Al2O3在化学反应前后质量是否变化.
【实验步骤】①准确称量Al2O3(少量)的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤,干燥,称量;④对比反应前后Al2O3的质量.
【交流讨论】如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂.
(3)【提出新的问题】但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验:探究Al2O3 在化学反应前后的化学性质是否改变.
【提出问题】Al2O3能不能作过氧化氢分解的催化剂呢?
【作出猜想】Al2O3能作过氧化氢分解的催化剂.
【实验验证】
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | ① | 有少量气泡 木条不复燃 | 常温下过氧化氢溶液分解速率很慢. |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 产生大量的气泡 木条复燃 | ② |
【得出结论】Al2O3能加快过氧化氢的分解速率,故Al2O3能作过氧化氢分解的催化剂.
(2)【反思提高】经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验:
实验三:
【实验目的】探究Al2O3在化学反应前后质量是否变化.
【实验步骤】①准确称量Al2O3(少量)的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤,干燥,称量;④对比反应前后Al2O3的质量.
【交流讨论】如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂.
(3)【提出新的问题】但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验:探究Al2O3 在化学反应前后的化学性质是否改变.
13.初中化学课上,同学们利用下列图1装置实验探究碱的化学性质:
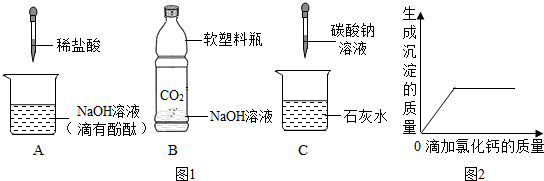
(1)B实验中反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.
(2)C实验中观察到的现象是澄清石灰水变浑浊.
(3)实验结束后,同学们将废液倒入同一只废液缸中,最后发现废液浑浊并显红色.
【提出问题】废液中含有什么物质?
【假设猜想】通过分析上述实验,同学们猜想:废液中除酚酞和水外一定含有NaCl.
老师问:废液中还可能有什么物质?某同学脱口而出:废液中含有氢氧化钠,他的说法正确吗?同学们认为不准确,理由是:Ca(OH)2、Na2CO3溶液也可使酚酞试液变红.于是引发了热烈讨论,下面是大家的发言:
【查阅资料】CaCl2+Na2CO3═CaCO3↓+2NaCl
( 4 )【实验验证】同学们对可能含有的物质进行确定,取一定量的废液过滤,向滤液中逐滴加入氯化钙溶液,根据反应现象绘制了如图2所示的示意图.
①【结论解释】分析图象数据得出可能含有的物质中,一定含有Na2CO3,
②【拓展提高】那么是否含有氢氧化钠呢?请你帮他继续完成实验,写出探究的实验方法:由于本身混有酚酞,所以可以观察沉淀后的溶液的颜色,若溶液变红,则含有NaOH;若溶液不变色,则不含NaOH.

(1)B实验中反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.
(2)C实验中观察到的现象是澄清石灰水变浑浊.
(3)实验结束后,同学们将废液倒入同一只废液缸中,最后发现废液浑浊并显红色.
【提出问题】废液中含有什么物质?
【假设猜想】通过分析上述实验,同学们猜想:废液中除酚酞和水外一定含有NaCl.
老师问:废液中还可能有什么物质?某同学脱口而出:废液中含有氢氧化钠,他的说法正确吗?同学们认为不准确,理由是:Ca(OH)2、Na2CO3溶液也可使酚酞试液变红.于是引发了热烈讨论,下面是大家的发言:
| 学生甲 | 还可能有Ca(OH)2、NaOH | 学生丙 | 还可能有Ca(OH)2、CaCl2 |
| 学生乙 | 还可能有NaOH、Na2CO3 | 学生丁 | 还可能有Na2CO3 |
| … | … |
( 4 )【实验验证】同学们对可能含有的物质进行确定,取一定量的废液过滤,向滤液中逐滴加入氯化钙溶液,根据反应现象绘制了如图2所示的示意图.
①【结论解释】分析图象数据得出可能含有的物质中,一定含有Na2CO3,
②【拓展提高】那么是否含有氢氧化钠呢?请你帮他继续完成实验,写出探究的实验方法:由于本身混有酚酞,所以可以观察沉淀后的溶液的颜色,若溶液变红,则含有NaOH;若溶液不变色,则不含NaOH.
11.比较、推理是化学学习常用的方法.以下是根据一些反应事实推导出的影响化学反应的因素,其中不合理的是( )
| 序号 | 化学反应事实 | 影响反应的因素 |
| A | 过氧化氢遇二氧化锰后迅速分解,水遇二氧化锰不分解 | 催化剂 |
| B | 镁与盐酸反应生成氢气,铜与盐酸不反应 | 反应物的种类 |
| C | 碳在常温下不与氧气反应,在点燃时能与氧气反应 | 反应的温度 |
| D | 红热的铁丝在空气中很难燃烧,在氧气中能剧烈燃烧 | 反应物的浓度 |
| A. | A | B. | B | C. | C | D. | D |
8.氢化钙(CaH2)是一种重要的制氢剂,与水发生反应:CaH2+2H2O═Ca(OH)2+2H2↑,在以上反应的化合物中,氢元素的化合价很独特的是( )
| A. | CaH2 | B. | H2O | C. | Ca(OH)2 | D. | H2 |
7.可用于除去氢氧化钠溶液中混有少量碳酸钠的试剂是( )
0 165823 165831 165837 165841 165847 165849 165853 165859 165861 165867 165873 165877 165879 165883 165889 165891 165897 165901 165903 165907 165909 165913 165915 165917 165918 165919 165921 165922 165923 165925 165927 165931 165933 165937 165939 165943 165949 165951 165957 165961 165963 165967 165973 165979 165981 165987 165991 165993 165999 166003 166009 166017 211419
| A. | 氢氧化钡溶液 | B. | 盐酸 | C. | 氯化钡溶液 | D. | 硝酸银溶液 |
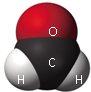 据中国室内装饰协会调查,甲醛污染大部分是由板材产生,家庭装修中使用的夹芯板、地板、家具等都可能释放出甲醛.我国的国家检测标准:“El级板材相当于甲醛释放量为1.5mg/L;E0级板材的甲醛释放量为0.5mg/L.”E1级与E0级最大的区别就是甲醛的释放量,El级比E0级释放甲醛量多五分之一.目前,化学家已能从马铃薯中提取植物胶做板材的黏合剂,有效地减少了甲醛的排放.试根据上述资料填空:
据中国室内装饰协会调查,甲醛污染大部分是由板材产生,家庭装修中使用的夹芯板、地板、家具等都可能释放出甲醛.我国的国家检测标准:“El级板材相当于甲醛释放量为1.5mg/L;E0级板材的甲醛释放量为0.5mg/L.”E1级与E0级最大的区别就是甲醛的释放量,El级比E0级释放甲醛量多五分之一.目前,化学家已能从马铃薯中提取植物胶做板材的黏合剂,有效地减少了甲醛的排放.试根据上述资料填空: