题目内容
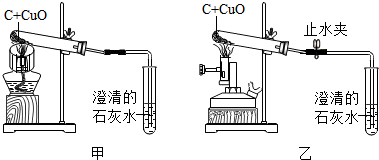
13.初中化学课上,同学们利用下列图1装置实验探究碱的化学性质: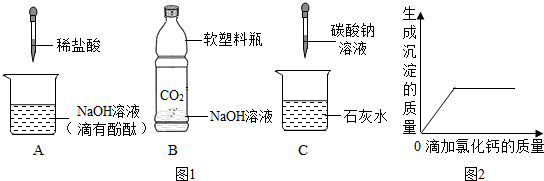
(1)B实验中反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.
(2)C实验中观察到的现象是澄清石灰水变浑浊.
(3)实验结束后,同学们将废液倒入同一只废液缸中,最后发现废液浑浊并显红色.
【提出问题】废液中含有什么物质?
【假设猜想】通过分析上述实验,同学们猜想:废液中除酚酞和水外一定含有NaCl.
老师问:废液中还可能有什么物质?某同学脱口而出:废液中含有氢氧化钠,他的说法正确吗?同学们认为不准确,理由是:Ca(OH)2、Na2CO3溶液也可使酚酞试液变红.于是引发了热烈讨论,下面是大家的发言:
| 学生甲 | 还可能有Ca(OH)2、NaOH | 学生丙 | 还可能有Ca(OH)2、CaCl2 |
| 学生乙 | 还可能有NaOH、Na2CO3 | 学生丁 | 还可能有Na2CO3 |
| … | … |
( 4 )【实验验证】同学们对可能含有的物质进行确定,取一定量的废液过滤,向滤液中逐滴加入氯化钙溶液,根据反应现象绘制了如图2所示的示意图.
①【结论解释】分析图象数据得出可能含有的物质中,一定含有Na2CO3,
②【拓展提高】那么是否含有氢氧化钠呢?请你帮他继续完成实验,写出探究的实验方法:由于本身混有酚酞,所以可以观察沉淀后的溶液的颜色,若溶液变红,则含有NaOH;若溶液不变色,则不含NaOH.
分析 (1)根据NaOH溶液吸CO2收生成Na2CO3和H2O进行分析;
(2)根据碳酸钠能与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠而使溶液变浑浊进行分析;
(3)【猜想假设】盐酸与氢氧化钠能反应生成氯化钠,故一定含有氯化钠,酚酞呈红色,说明溶液呈碱性;
【结论解释】根据图象,加入氯化钙产生沉淀,说明一定含有碳酸钠,有碳酸钠则不能含有氢氧化钙和氯化钙;
【拓展提高】根据氢氧化钠呈碱性且氢氧化钠不与氯化钙反应进行分析解答.
解答 解:(1)NaOH溶液吸收CO2生成Na2CO3和H2O,化学方程式为:2NaOH+CO2═Na2CO3+H2O;
(2)碳酸钠与石灰水反应生成碳酸钙沉淀(CaCO3)和氢氧化钠,所以C试验的现象是澄清石灰水变浑浊;
(3)【猜想假设】盐酸能与氢氧化钠反应生成氯化钠,氯化钠不与其他物质反应,所以一定含有氯化钠,溶液呈现红色,说明溶液呈碱性,呈碱性的物质除了氢氧化钠,还有氢氧化钙和碳酸钠;
【结论解释】根据图象,加入氯化钙产生沉淀,说明一定含有碳酸钠,有碳酸钠则不能含有氢氧化钙和氯化钙;
【拓展提高】所得的混合液中含有酚酞,加入氯化钙的时候,氯化钙只与碳酸钠反应产生白色沉淀,若沉淀后溶液的颜色呈红色,则含有氢氧化钠,若溶液是无色,则不含有氢氧化钠.
故答案为:(1)2NaOH+CO2═Na2CO3+H2O;
(2)澄清石灰水变浑浊;
(3)①NaCl;
②Ca(OH)2、Na2CO3溶液也可使酚酞试液变红;
(4)①Na2CO3;
②由于本身混有酚酞,所以可以观察沉淀后的溶液的颜色,若溶液变红,则含有NaOH;若溶液不变色,则不含NaOH.
点评 本题利用各种试验现象推断物质的成分.考查碱在化学反应中的性质.完成此题,可以依据已有的物质的性质以及物质间反应的实验现象进行.

 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案 某同学为了探索物质的性质,以氧气为例,做了如下实验:
某同学为了探索物质的性质,以氧气为例,做了如下实验:如图所示先收集了一瓶氧气(注意:瓶口向上)后正放在桌上,盖好玻璃片,然后用带火星的木条插入集气瓶,木条复燃从实验可以说明氧气的性质是( )
| A. | 氧气密度比空气小 | B. | 氧气可以燃烧 | ||
| C. | 氧气能供给呼吸 | D. | 氧气能支持燃烧 |
| A. | CaH2 | B. | H2O | C. | Ca(OH)2 | D. | H2 |
| A. | CO2分子有碳元素和氧元素构成 | |
| B. | 干冰和二氧化碳气体都是由相同分子构成的 | |
| C. | 分子在0℃停止无规则运动 | |
| D. | 显微镜下可以看到化学变化时分子没有重新组合 |
 (1)该反应的化学方程式为:H2SO4+2NaOH=Na2SO4+2H2O.
(1)该反应的化学方程式为:H2SO4+2NaOH=Na2SO4+2H2O.