9.下列化学符号中的数字表示的意义不正确的是( )
| A. | CO2:“2”表示一个二氧化碳分子含有两个氧原子 | |
| B. | 2Fe:“2”表示两个铁元素 | |
| C. | $\stackrel{+2}{Mg}$:“+2”表示镁元素的化合价为+2价 | |
| D. | 2NH4+:“2”表示两个铵根离子 |
8.下列各组物质中,化学性质不相似的是( )
| A. | 稀盐酸、稀硫酸 | B. | 一氧化碳、二氧化碳? | ||
| C. | 碳、氢气 | D. | 氢氧化钙、氢氧化钠 |
6.射阳酒厂酿造的花露酒远近闻名,从化学的角度看,花露酒可以看成是酒精的水溶液,酒精的学名叫乙醇(C2H5OH),下列有关乙醇的说法错误的是( )
| A. | 属于有机物 | B. | 乙醇充分燃烧,生成二氧化碳和水 | ||
| C. | 碳、氢元素的质量比是1:3 | D. | 1个乙醇分子含有9个原子 |
1.化学课外兴趣小组同学取用一定质量的石灰石样品,把50.0g稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如表:
下列有关说法不正确的是( )
| 实验次数 | 一 | 二 | 三 | 四 | 五 |
| 稀盐酸的加入量 | 10g | 10g | 10g | 10g | 10g |
| 剩余固体的质量 | 3.0g | 2.0g | 1.0g | m | 0.6g |
| A. | 石灰石样品的质量为4g | B. | m的值为0.8g | ||
| C. | 石灰石中碳酸钙的质量分数为85% | D. | 稀盐酸中溶质质量分数为7.3% |
20.兴趣小组的同学们在帮助老师整理实验室时,发现一瓶氢氧化钾(化学式KOH)固体,大家决定用实验的方法对这瓶粉末样品展开探究,请你参与.
[活动一]探究氢氧化钾样品的组成
资料摘要:①氢氧化钾的化学性质与氢氧化钠(化学式:NaOH)相似;
②碳酸钾的水溶液呈碱性,氯化钙、氯化钾的水溶液呈中性;
③碳酸钾与氯化钙反应的化学方程式为:K2CO3+CaCl2═CaCO3↓+2KCl.
(1)小刚同学取少量样品于试管中,滴加稀盐酸,发现有气泡产生,由此可以确定这样氢氧化钾样品,已经变质,请写出氢氧化钾变质过程的化学反应方程式:2KOH+CO2═K2CO3+H2O.
(2)为了进一步确定样品中是否存在氢氧化钾,兴趣小组的同学进行了如下实验:
请简述步骤Ⅱ滴加的氯化钙溶液已足量的方法:静置,取上层清液,再滴加CaCl2溶液,若无白色沉淀产生,则CaCl2溶液已足量(写出实验步骤、现象和结论).
[活动二]测定样品中碳酸钾的质量分数
取10g样品与足量的稀硫酸反应,通过测定反应产生的二氧化碳气体的质量,可计算碳酸钾的质量分数(装置气密性已检验,夹持装置已省略).
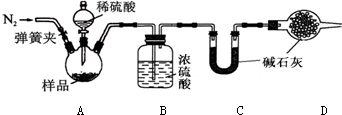
(资料:浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳)
(3)打开弹簧夹,先对装置A和B通入N2一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(4)关闭弹簧夹,加入足量的稀硫酸,装置A中样品产生气体的化学反应方程式为K2CO3+H2SO4═K2SO4+H2O+CO2↑.
(5)实验结束后,还要再通一会儿N2.若没有再通一会儿N2,则测得样品中碳酸钾的质量分数将偏低(选填“偏高”、“偏低”或“不变”).
(6)经测定装置C增重0.88g,则10g样品中碳酸钾的质量分数为27.6%.
0 164850 164858 164864 164868 164874 164876 164880 164886 164888 164894 164900 164904 164906 164910 164916 164918 164924 164928 164930 164934 164936 164940 164942 164944 164945 164946 164948 164949 164950 164952 164954 164958 164960 164964 164966 164970 164976 164978 164984 164988 164990 164994 165000 165006 165008 165014 165018 165020 165026 165030 165036 165044 211419
[活动一]探究氢氧化钾样品的组成
资料摘要:①氢氧化钾的化学性质与氢氧化钠(化学式:NaOH)相似;
②碳酸钾的水溶液呈碱性,氯化钙、氯化钾的水溶液呈中性;
③碳酸钾与氯化钙反应的化学方程式为:K2CO3+CaCl2═CaCO3↓+2KCl.
(1)小刚同学取少量样品于试管中,滴加稀盐酸,发现有气泡产生,由此可以确定这样氢氧化钾样品,已经变质,请写出氢氧化钾变质过程的化学反应方程式:2KOH+CO2═K2CO3+H2O.
(2)为了进一步确定样品中是否存在氢氧化钾,兴趣小组的同学进行了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| Ⅰ.取少量样品,加水. | 样品全部溶解 | |
| Ⅱ.取溶液于试管中,滴入足量的CaCl2溶液,过滤. | 产生白色沉淀 | 溶液中含有K2CO3. |
| Ⅲ.取Ⅱ所得的滤液于另一试管中,滴加无色酚酞试液. | 酚酞试液变红色 | 溶液中含有KOH. |
[活动二]测定样品中碳酸钾的质量分数
取10g样品与足量的稀硫酸反应,通过测定反应产生的二氧化碳气体的质量,可计算碳酸钾的质量分数(装置气密性已检验,夹持装置已省略).

(资料:浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳)
(3)打开弹簧夹,先对装置A和B通入N2一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(4)关闭弹簧夹,加入足量的稀硫酸,装置A中样品产生气体的化学反应方程式为K2CO3+H2SO4═K2SO4+H2O+CO2↑.
(5)实验结束后,还要再通一会儿N2.若没有再通一会儿N2,则测得样品中碳酸钾的质量分数将偏低(选填“偏高”、“偏低”或“不变”).
(6)经测定装置C增重0.88g,则10g样品中碳酸钾的质量分数为27.6%.