题目内容
5.写出下列化学符号中数字“2”所表示的意义:(1)Fe2+:每个亚铁离子带的电荷数;
(2)2CO:一氧化碳分子的个数;
(3)CO2:每个二氧化碳分子含有的氧原子个数.
分析 元素符号右上角的数字表示每个离子带的电荷数;
一氧化碳的化学式前面加上相应的数字可以表示一氧化碳分子的个数;
二氧化碳的化学式中氧元素的元素符号右下角的数字表示每个二氧化碳分子中含有的氧原子个数.
解答 解:(1)Fe2+中的2表示每个亚铁离子带的电荷数;
(2)2CO中的2表示一氧化碳分子的个数;
(3)CO2中的2表示每个二氧化碳分子含有的氧原子个数.
故填:每个亚铁离子带的电荷数; 一氧化碳分子的个数;每个二氧化碳分子含有的氧原子个数.
点评 本题主要考查学生对化学用语的书写和理解能力,题目重点考查对化学符号中数字意义的了解,考查全面,注重基础,题目难度较小.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
6.王老师用自制的花肥给教室里的花施肥时,同学们对这包花肥的成分产生了兴趣.王老师只告诉大家,这种花肥他是用KNO3、NH4Cl、Ca(NO3)2、KCl、K2CO3中的几种固定配制而成的.
(1)为确定花肥的成分,小伟同学设计了以下实验,请你与他一起完成.
(2)小倩同学提出,实验Ⅱ不能得出相应的结论,还可能含有氯化铵,她的理由是氯化铵也能和硝酸银反应生成白色沉淀.为此,应该补充的实验是
(3)通过对以上实验的分析,你认为这包花肥的组成共有两种可能.
(1)为确定花肥的成分,小伟同学设计了以下实验,请你与他一起完成.
| 实验 | 实验操作 | 实验现象 | 结论及化学方程式 |
| I | 取少量花肥于试管中,加水溶解,得无色溶液.向其中滴加少量碳酸钠溶液 | 有白色沉淀产生 | 一定有Ca(NO3)2化学方程式Ca(NO3)2+Na2CO3=CaCO3↓+2NaNO3 |
| Ⅱ | 另取少量花肥于试管中,加水溶解,得无色溶液.向其中滴加适量AgNO3溶液 | 有白色沉淀产生 | 一定有KCl |
| 实验操作 | 实验现象 | 实验结论 |
| 取少量花肥加熟石灰研磨 | 无氨味 | 没有NH4Cl |
13.鉴别下列物质所用的方法或试剂,错误的是( )
| A. | 纯铝和硬铝--比较硬度 | B. | 蔗糖水和食盐水--观察颜色 | ||
| C. | 碳酸钠和氯化钠--稀盐酸 | D. | 羊毛纤维和合成纤维--点燃闻气味 |
20.兴趣小组的同学们在帮助老师整理实验室时,发现一瓶氢氧化钾(化学式KOH)固体,大家决定用实验的方法对这瓶粉末样品展开探究,请你参与.
[活动一]探究氢氧化钾样品的组成
资料摘要:①氢氧化钾的化学性质与氢氧化钠(化学式:NaOH)相似;
②碳酸钾的水溶液呈碱性,氯化钙、氯化钾的水溶液呈中性;
③碳酸钾与氯化钙反应的化学方程式为:K2CO3+CaCl2═CaCO3↓+2KCl.
(1)小刚同学取少量样品于试管中,滴加稀盐酸,发现有气泡产生,由此可以确定这样氢氧化钾样品,已经变质,请写出氢氧化钾变质过程的化学反应方程式:2KOH+CO2═K2CO3+H2O.
(2)为了进一步确定样品中是否存在氢氧化钾,兴趣小组的同学进行了如下实验:
请简述步骤Ⅱ滴加的氯化钙溶液已足量的方法:静置,取上层清液,再滴加CaCl2溶液,若无白色沉淀产生,则CaCl2溶液已足量(写出实验步骤、现象和结论).
[活动二]测定样品中碳酸钾的质量分数
取10g样品与足量的稀硫酸反应,通过测定反应产生的二氧化碳气体的质量,可计算碳酸钾的质量分数(装置气密性已检验,夹持装置已省略).
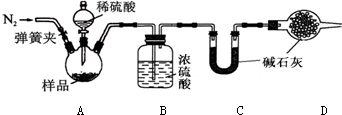
(资料:浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳)
(3)打开弹簧夹,先对装置A和B通入N2一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(4)关闭弹簧夹,加入足量的稀硫酸,装置A中样品产生气体的化学反应方程式为K2CO3+H2SO4═K2SO4+H2O+CO2↑.
(5)实验结束后,还要再通一会儿N2.若没有再通一会儿N2,则测得样品中碳酸钾的质量分数将偏低(选填“偏高”、“偏低”或“不变”).
(6)经测定装置C增重0.88g,则10g样品中碳酸钾的质量分数为27.6%.
[活动一]探究氢氧化钾样品的组成
资料摘要:①氢氧化钾的化学性质与氢氧化钠(化学式:NaOH)相似;
②碳酸钾的水溶液呈碱性,氯化钙、氯化钾的水溶液呈中性;
③碳酸钾与氯化钙反应的化学方程式为:K2CO3+CaCl2═CaCO3↓+2KCl.
(1)小刚同学取少量样品于试管中,滴加稀盐酸,发现有气泡产生,由此可以确定这样氢氧化钾样品,已经变质,请写出氢氧化钾变质过程的化学反应方程式:2KOH+CO2═K2CO3+H2O.
(2)为了进一步确定样品中是否存在氢氧化钾,兴趣小组的同学进行了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| Ⅰ.取少量样品,加水. | 样品全部溶解 | |
| Ⅱ.取溶液于试管中,滴入足量的CaCl2溶液,过滤. | 产生白色沉淀 | 溶液中含有K2CO3. |
| Ⅲ.取Ⅱ所得的滤液于另一试管中,滴加无色酚酞试液. | 酚酞试液变红色 | 溶液中含有KOH. |
[活动二]测定样品中碳酸钾的质量分数
取10g样品与足量的稀硫酸反应,通过测定反应产生的二氧化碳气体的质量,可计算碳酸钾的质量分数(装置气密性已检验,夹持装置已省略).

(资料:浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳)
(3)打开弹簧夹,先对装置A和B通入N2一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(4)关闭弹簧夹,加入足量的稀硫酸,装置A中样品产生气体的化学反应方程式为K2CO3+H2SO4═K2SO4+H2O+CO2↑.
(5)实验结束后,还要再通一会儿N2.若没有再通一会儿N2,则测得样品中碳酸钾的质量分数将偏低(选填“偏高”、“偏低”或“不变”).
(6)经测定装置C增重0.88g,则10g样品中碳酸钾的质量分数为27.6%.
10.下列化学方程式与事实相符且正确的是( )
| A. | 治疗胃酸过多:Mg(OH)2+H2SO4=MgSO4+2H2O | |
| B. | 二氧化碳气体的检验:CO2+Ca(OH)2=CaCO3↓+H2O | |
| C. | 硫酸铜溶液和氢氧化钠溶液反应:CuSO4+NaOH=CuOH↓+NaSO4 | |
| D. | 洗去试管壁上的附着的铜:Cu+H2SO4=CuSO4+H2↑ |
14.下列做法不能成功的是( )
| A. | 用热的纯碱溶液除暖水瓶中的水垢 | B. | 用铅笔芯代替石墨实验导电性 | ||
| C. | 用加热的方法给聚乙烯塑料袋封口 | D. | 用水区分硝酸铵和氯化钠固体 |

